Данная статья является реферативным изложением основной работы. Полный текст научной работы, приложения, иллюстрации и иные дополнительные материалы доступны на сайте II Международного конкурса научно-исследовательских и творческих работ учащихся «Старт в науке» по ссылке: https://www.school-science.ru/2017/1/26532.
Кузбасс место огромного количества угледобывающих шахт и разрезов. И, как и в любой отрасли, угледобывающая, сталкивается с определенными проблемами. Одной из самых основных является наличие в шахтах метана. В шахтах метан скапливается в пустотах среди пород, в основном, под кровлей выработок и может создавать взрывоопасные метановоздушные смеси. В старину шахтёры брали с собой в шахту клетку с канарейкой, и пока слышалось пение птицы можно было работать спокойно: в шахте нет метана. Если же канарейка замолкала на долгое время, а еще хуже – навсегда, значит – рядом смерть. В начале XIX века известный химик Х. Дэви изобрел безопасную шахтерскую лампу, затем на смену ей пришло электричество, но взрывы на угольных шахтах продолжались. В настоящее время концентрация метана в рудничной атмосфере контролируется автоматическими системами газовой защиты.
Может ли еще что-то служить анализатором среды? Современные газоанализаторы дороги, использование канареек, на мой взгляд, не гуманно. Мы задались вопросом: можно ли создать анализатор среды на основе бактерий, ведь микроорганизмы очень чувствительны к среде обитания. В первой части своей работы я буду изучать, то как среды могут воздействовать на бактериальные культуры
Гипотезой является предположение о том, что бактериологические культуры реагируют на изменение среды неодинаково
Цель: изучение влияние среды на бактериологические культуры
Задачи:
1. Изучить литературу по данной теме
2. Выбрать методики проведения исследований бактериальных культур
3. Провести эксперименты с бактериальными культурами;
4. Сформулировать требования к бактериальной культуре – анализатору среды;
Объект исследования: факторы среды, влияющие на жизнедеятельность бактериологических культур.
Предмет исследования: характер воздействия факторов среды на рост бактерий.
Методы: эксперимент, наблюдение, математическая обработка данных.
Приборы и материалы
Для посевов будут использованы чашки Петри диаметром 90 мм, в качестве среды для посева используется порошок сухого агара. Для отбора проб будут использованы стерильные марлевые салфетки и стерильные резиновые перчатки. Для обработки посевов будут использованы следующие препараты: вода, дегтярное мыло, обычное мыло, глицериновое мыло, жидкое антисептическое мыло Dettol, антисептическое мыло Safeguard, мыло с экстрактом ромашки, отвар ромашки, спирт, гелевый антисептик, противогрибковый препарат широкого спектра действия, антибиотик широкого спектра действия, раствор хлора 50 %, раствор сахара. Для работ по наблюденью за посевами будут использованы восьмикратное увеличительное стекло на подставке. В качестве обеззараживающих растворов для утилизации отработанных сред использовался раствор хлора 50 %. Для безопасности работ со средами использовались одноразовые резиновые перчатки, респиратор, защитные очки.
Методика эксперимента
Подготовка питательной среды
Для отбора проб микроорганизмов существует множество разновидностей питательных сред: мясо-пептонный бульон (МПБ), мясо-пептонный агар (МПА), среда Лурия-Бертани (среда ЛБ), желточно-солевой агар и другие.
При проведении исследований использована среда, приготовленная из питательного сухого агара.
Для приготовления среды я размешала 25 г порошка в 1 л дистиллированной воды, довела до кипения. Кипячение производила до полного расплавления агара (2-3 мин), потом профильтровала через ватный тампон. Перед розливом в чашки Петри среда была охлаждена до 50 °С. По инструкции, среды нужно выдерживать в термостате и автоклаве. Но, так как цель нашей работы не получить чистую культуру, а выявить наличие бактерий, эти пункты были пропущены.
Методика посева образцов
Для посевов № № 30, 31, 32, 33, 34 были взяты мазки с предметов быта. Для этого стерильной марлевой салфеткой были произведены мазки по предмету, после чего салфетка была помещена на некоторое время на питательную среду.
Материал для посева № 30 брался с клавиатуры ПК, № 31 – сенсорного экрана телефона, № 32 – клавиатуры телевизионного пульта, № 33 – денежной купюры, № 34 – дверной ручки.
Для посевов № № 1-20 была использована иная методика. Рука, с которой были взяты посевы, была одета в резиновую перчатку. Затем с перчатки срезался один палец. Освобожденным пальцем делалось прикосновение к питательной среде. Затем палец обрабатывался антисептическим раствором, и делалось еще одно прикосновение. Затем процедура повторялась со следующим пальцем. Данные действия были направлены на то, чтобы каждый палец обрабатывался только одним антисептическим препаратом.
Пробы № № 1, 3, 5, 7, 9, 11, 13, 15, 17, 19 – посев пальцем без обработки.
Проба № 2 – обработка водой, № 4 – дегтярным мылом, № 6 – обычным мылом, № 8 – глицериновым мылом, № 10 – антисептическим мылом Dettol, № 12 – антисептическим мылом Safeguard, № 14 – мылом с содержанием ромашки, № 16 – отвар ромашки, № 18 – спиртом, № 20 – гелевым антисептиком.
В ходе работы с чашками, каждая из них была пронумерована.
После проведения посевов чашки Петри были перевернуты и помещены в темное место со стабильной температурой. Для фиксации происходящих изменений был создан журнал наблюдений.
Работа с микробиологическими культурами
Выделение бактериальных культур
Так как посевы производились с неизвестными заранее микробиологическими культурами, то велика вероятность того, что в чашки, наряду с бактериями могли попасть грибковые культуры. Часто развитие одних организмов угнетает развитие другие, а некоторые способны выделять особые вещества – антибиотики.
Для устранения такого влияния, после того как в чашках появились видимые невооруженным глазом колонии микроорганизмов, чашки были обработаны противогрибковым средством широкого спектра действия.
В результате наблюдения было установлено, что рост части колоний остановился, что позволило сделать следующие выводы:
1. Часть микробиологических колоний являлись грибковыми.
2. Увеличение числа КОЕ и рост размеров колоний, свидетельствует о снижении конкуренции между грибковыми и бактериологическими культурами
Проверка влияния антисептических растворов бактериальную активность
Для этого этапа были взяты посевы № № 1-20.
В посевах, подвергшихся обработке, определим антибактериальную активность вещества, которым обработаны посевы. Для оценки активности рассчитывается относительное снижение числа микроорганизмов в посеве по сравнению с контрольным опытом. По формуле, предложенной Л.В. Антадзе
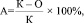
где К – число микроорганизмов в контроле, О – число микроорганизмов в опыте.
Все не антисептические растворы значительно уменьшают количество выживших после обработки бактерий.
Проверка влияния сред на бактериальную активность
Для этого этапа были взяты посевы № № 30-34.
Для проверки влияния среды я выбрала следующие факторы
1. Температурный фактор: чашка с образцами была вынесена на мороз (посев № 32).
2. Биологический фактор (антибиотики): чашка была обработана антибиотиком широкого спектра действия (посев № 31).
3. Химическая фактор: чашка была обработана раствором хлора (посев № 30).
4. Фактор среды (положительный): в чашку добавлен раствор сахара (посев № 33).
5. УФ воздействие: чашка подвергалась УФ облучению (посев № 34).
Вследствии этих воздействий, мы получили следующие результаты.
1. Температурный фактор: Количество КОЕ не изменилось, размер колоний не изменился. Следовательно, значительное снижение температуры прекращает рост бактерий
2. Биологический фактор (антибиотики): Количество КОЕ уменьшилось, размер колоний уменьшился. Следовательно, антибиотики значительно влияет на количество бактерий. Оставшиеся колонии можно объяснить устойчивостью к данному антибиотику.
3. Химическая фактор: бактериальные колонии практически исчезли. Следовательно, агрессивное химическое воздействие может полностью уничтожить колонии бактерий.
4. Фактор среды (положительный): в чашку добавлен раствор сахара
Количество КОЕ увеличилось, размер колоний увеличился. Следовательно, повышение и/или изменение питательности среды значительно влияет на количество бактерий. Новые КОЕ можно объяснить изменением питательной среды
5. УФ воздействие: Количество КОЕ уменьшилось, размер колоний уменьшился. Следовательно, УФ излучение значительно влияет на количество бактерий. Оставшиеся колонии можно объяснить недостаточным временем воздействия.
В посевах, подвергшихся обработке, определим антибактериальную активность вещества, которым обработаны посевы. Для оценки активности рассчитывается относительное снижение числа микроорганизмов в посеве по сравнению с контрольным опытом. Опять используем формулу предложенную Антадзе.
Воздействие раствором хлора, антибиотиком и УФ-излучением значительно уменьшили количество бактерий в посеве. Добавление же раствора сахара значительно увеличило количество КОЕ, добавив бактериям питательной среды. Нулевое значение воздействия после помещения посева в условия низкой температуры не означает, что не произошло антибактериального воздействия. Просто для исчезновения имеющихся колоний бактерий или появления новых КОЕ должно пройти большее время. Но холод полностью остановил рост уже имеющихся КОЕ.
Заключение
Изучив литературу, я смогла грамотно подойти к выполнению исследования. Подбор методики позволил провести эксперимент и получить достоверные результаты. Проведенный эксперимент помог сформировать мне список требований к бактериальной культуре, которая могла бы служить анализатором среды
Большинство сред, так или иначе, воздействует на бактериальные культуры. Фактор среды может замедлить, ускорить или полностью уничтожить бактерии. Это позволяет сделать следующий вывод: существует возможность подобрать бактериальную культуру, которая будет реагировать на необходимое изменение среды и не реагировать на остальные факторы, тем самым выполняя роль маркера.
Моя гипотеза полностью подтвердилась. На рост бактерий факторы среды оказывают значительное влияние. Выполнение данной работы помогло сформировать мне список требований к бактериальной культуре, которая могла бы служить анализатором среды. Например, такая культура могла бы определять содержание метана в шахте.
Культура – анализатор среды, должна удовлетворять следующим условиям:
1. Быстрый рост
2. Непатогенность
3. Видимый маркер (фосфоресценция или яркая окраска)
4. Резистентность (нетребовательность к условиям роста, кроме определяемого вещества)
5. Эвритермность (нетребовательность к температурному диапазону)
Подбор данной бактерии требует исследований только в лабораторных условиях, зато этот способ позволил определять вещества, определение которых другими способами дорого или невозможно.
Библиографическая ссылка
Равко А.В. ИССЛЕДОВАНИЕ ВОЗДЕЙСТВИЯ ФАКТОРОВ СРЕДЫ НА РОСТ БАКТЕРИЙ // Старт в науке. 2016. № 6. ;URL: https://science-start.ru/ru/article/view?id=517 (дата обращения: 10.03.2026).
