Введение
Проблема сохранения здоровья населения страны очень актуальна в настоящее время для нашего государства. Правильное питание является обязательным компонентом здорового образа жизни, служит фактором профилактики основных заболеваний современного человека: сердечно-сосудистых, онкологических, эндокринологических и д.р. Растительное сырье является уникальным источником биологически активных веществ (дубильные вещества, органические кислоты, гликозиды, аминокислоты, флавоноиды и другие), оказывающих общеукрепляющее действие на организм.Флавоноиды составляют обширную группу природных соединений. Впервые выделенный из растений в 1814 году флавоноид имел желтую окраску, отсюда и название (от латинского "flavus" - "желтый"). К настоящему времени установлена структура и описаны физико-химические характеристики более 7500 природных флавоноидов [6]. Флавоноиды – крупнейший класс биологически активных веществ растительного происхождения. Они являются мощными природными антиоксидантами, укрепляют стенки сосудов и нормализуют артериальное давление, стимулируют иммунитет, оказывают противовоспалительное, противоопухолевое, противоаллергическое действия. Флавоноиды нетоксичны, не вызывают побочных эффектов, этим и обусловлено их широкое применение в медицине. Привлекают внимание антимикробные свойства флавоноидов. Выявлено отрицательное влияние кверцетина на грамположительные бактерии, флавонов и халконов - на стафилококк, стрептококк, антимикробное действие отмечалось у антоцианов и катехинов чая [3]. Широкий диапазон терапевтических возможностей флавоноидов позволяет считать их источниками средств общего положительного на организм действия. Флавоноидные препараты необходимы не только для лечения заболеваний, но и для профилактики нарушений у здоровых лиц [7].
В организме флавоноиды не синтезируются, важным для здоровья человека является их ежедневное употребление с пищей. Вследствие этого, актуальным является исследование количественного содержания флавоноидов в различных продуктах питания.
Цель исследования.
Целью нашего исследования являетсясравнение качественного и количественного содержания флавоноидов в растительном сырье и разработка рекомендаций по применению травяных чаев в образовательных учреждениях.
В связи с целью были поставлены следующие задачи:
1. Изучить информацию по теме.
2. Провести разделение флавоноидов спиртовых экстрактов и водных настоев растительного сырья методом бумажной хроматографии.
3. Провести качественный анализ содержания флавоноидов в растительном сырье.
4. Определить количественное содержание флавоноидов в растительном сырье.
5. Составить рецепты травяных чаев для школьного буфета.
Объекты исследования: ягоды смородины, клюква, плоды шиповника, боярышника, черноплодной рябины, яблоки, цедра лимона, апельсина, цветы липы, ромашка, чабрец, календула, черный чай и др.
В ходе выполнения исследования «Содержание флавоноидов в растительном сырье и их роль в укреплении здоровья» был подробно изучен теоретический материал по теме. Разобраны методики качественного и количественного анализа содержания флавоноидов в различном растительном сырье, выбрана наиболее доступная методика для выполнения в условиях школьной лаборатории. Предложена рецептура травяных чаев для учащихся с выявленными хроническими заболеваниями.
Материалы и методы
Выделение флавоноидов из растительного сырья: для исследования были выбраны ягоды смородины, клюква, плоды шиповника, боярышника, черноплодной рябины, яблоки, цедра лимона, апельсина, цветы липы, ромашка, чабрец, календула, черный чай. Для приготовления спиртового экстракта 2,5 г высушенного измельченного растительного сырья помещали в колбу, добавляли 25 мл 70% этилового спирта, экстракцию проводили на кипящей водяной бане в течение 20 минут. Для приготовления водного настоя 2,5 г высушенного измельченного растительного сырья помещали в колбу, добавляли 25 мл воды, экстракцию проводили на кипящей водяной бане в течение 20 минут. Полученные извлечения охлаждали, фильтровали и использовали для дальнейшего анализа.
Метод бумажной хроматографии: бумажная хроматография – один из видов распределительной хроматографии. В качестве носителя мы использовали хроматографическую бумагу. Исследуемое вещество наносится в виде капель на расстоянии 1 см от края хроматографической бумаги, которую помещают в хроматографическую камеру с 60% уксусной кислотой в качестве элюирующего раствора, который передвигается по бумаге под действием капиллярных сил [1]. Нанесенное вещество движется с током растворителя. Вещества, хуже сорбирующиеся на волокнах бумаги, передвигаются быстрее. Потом бумагу высушивают, смотрят окраску пятен в УФ-свете, обрабатывают проявителем, наблюдают изменения окраски пятен.
Окраска пятен флавоноидов на хроматограммах [2]
|
Соединения |
Окраска пятен в УФ-свете |
||
|
до проявления |
с раствором AlCl3 и нагреванием при 100-105⁰С 3-5 мин. |
с раствором КОН |
|
|
Катехины |
Не окрашены |
Не окрашены |
Бесцветная, переходящая в желтую |
|
Флавонолы |
Желтая |
Ярко-желтая |
Желтая |
|
Флавоны |
Коричневая |
Желтая, желто-зеленая |
Желтая, желто-зеленая |
|
Флаваноны |
Не окрашены |
Слабо-желтая |
Желто-оранжевая |
|
Халконы |
Оттенки желтого |
Желто-оранжевая |
Оранжево-красная |
|
Ауроны |
Оттенки красного |
Оранжево-красная |
Оттенки красного |
Качественный анализ содержания флавоноидов в растительном сырье: общей реакции, специфической для всех классов флавоноидов, не существует. Наиболее часто для обнаружения флавоноидов применяют цианидиновую реакцию (проба Chinoda):
1. Цианидиновая реакция
Реакция основана на восстановлении флавоноидов атомарным водородом в кислой среде до антоцианидинов [2]. Флавонолы и флавонол-3-гликозидыдают ярко-розовое, красное или оранжевое окрашивание.Цианидиновую реакцию не дают халконы, ауроны, катехины, антоцианидины.
2. Реакция с раствором 5% хлорида алюминия
Флавоноиды, имеющие две оксигруппы в С3и С5положениях дают хелаты желтого цвета за счет образования водородных связей между карбонильной и гидроксильными группами. Раствор окрашивается в желтый цвет.
3. Реакция с раствором аммиака, гидрокарбонатом натрия, щелочью.
Проводится для определения основного структурного типа флавоноидов и ориентации гидроксильных групп. Флавоны, флавонолы, флаваноны приобретают желтое окрашивание, при нагревании переходящее в оранжевое или красное; халконы и ауроны – оранжевое или красное окрашивание. Антоцианы образуют синее или фиолетовое окрашивание [2].
4. Реакции с солями железа.
Образуются окраски от зеленой (флавонолы) до коричневой (флаваноны, халконы, ауроны) и красновато-бурой (флавоны) [2].
5. Реакции с ацетатом свинца
Флавоны, халконы, ауроны, содержащие свободные орто-гидроксильные группы в кольце В образуют осадки, окрашенные в ярко-желтый или красный цвета. Антоцианы образуют осадки, окрашенные как в красный, так и синий цвет [2].
6. Реакция с 1% раствором ванилина в концентрированной соляной кислоте.
Катехины (а также производные флороглюцина и резорцина) образуют малиново-красное окрашивание.
Фотометрический метод количественного определения флавоноидов в растительном сырье: метод основан на образовании окрашенного в желтый цвет комплексного соединения флавоноидов с 1% спиртовым раствором хлорида алюминия [1].Для построения калибровочного графика использовали спиртовой и водный растворы рутозида (0,5 мг/мл).
Схема разведения раствора рутозида
|
№ |
С, мг/мл |
V H2O, мл |
V рутозида, мл |
|
1 |
0,5 |
0 |
1 |
|
2 |
0,4 |
0,2 |
0,8 |
|
3 |
0,3 |
0,4 |
0,6 |
|
4 |
0,2 |
0,6 |
0,4 |
|
5 |
0,1 |
0,8 |
0,2 |
|
6 |
0 |
1 |
0 |
К 1 мл раствора добавляли 1 мл хлорида алюминия, измеряли оптическую плотностьна КФК-3 при длине волны 410 нм в кювете с толщиной слоя 10 мм. Извлечения, полученные из растительного сырья, разводили в 10 раз, конечный объем составлял 1 мл, далее определения проводили по той же схеме.
Содержание флавоноидов (%) в образцах вычисляли по формуле:
Х = (250 Dх/ kmх)*100%,
где Dx, - оптическая плотность исследуемого раствора, тх- масса сырья (мг), k– коэффициент пересчета
Заключение
Согласно методикам выделения флавоноидов, встречающимся в литературе, экстракцию проводят органическими растворителями. В работе мы определяли качественный состав и количественное содержание флавоноидов спиртовых экстрактов и водных настоев растительного сырья.
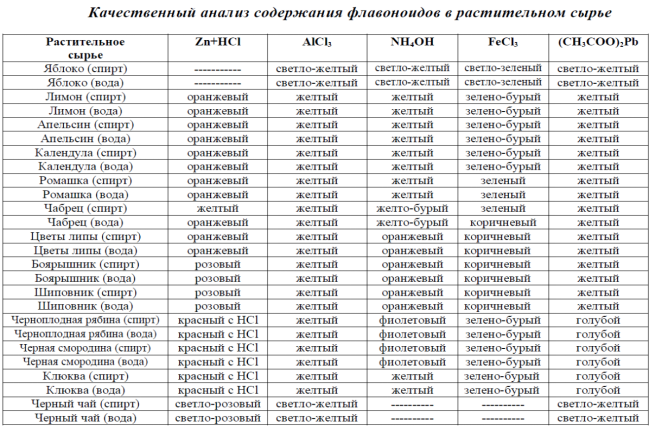
Методами качественного анализа флаваноиды были обнаружены во всех изучаемых образцах.
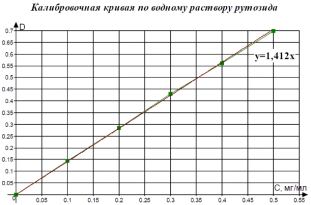
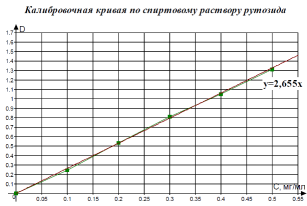 |
По результатам работы было установлено, что для всех исследуемых объектов характерно более высокое общее количественное содержание флавоноидов в пересчете на рутозид в спиртовых экстрактах, по сравнению с водными настоями.
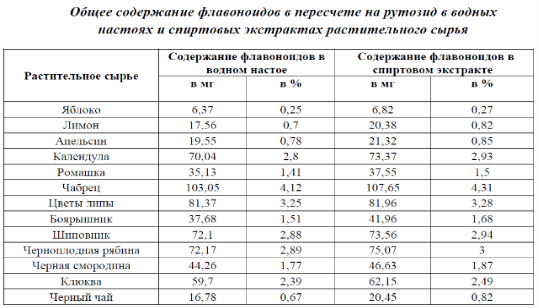
Тем не менее, достаточно высокое общее количественное содержание флавоноидов обнаружено в водных настоях цветов липы, чабреца, плодов шиповника, черноплодной рябины, клюквы. Разделение флавоноидов проводили методом бумажной хроматографии. В спиртовых экстрактах и водных настоях растительного сырья были обнаружены следующие классы флавоноидов: флаванолы, флаваноны, флавоны, халконы, ауроны. Флуоресценция пятен в УФ-свете до проявления и после обработки проявителями интенсивнее при разделении спиртовых экстрактов.
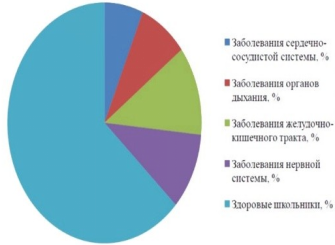
Мы проанализировали данные медицинского пункта о распространенности различных групп хронических заболеваний среди школьников ГБОУ ПО "Губернский лицей-интернат для одаренных детей".
Нами была предложена рецептура травяных чаев для коррекции и профилактики данных патологий [4, 5]:
•Желудочный чай (основной компонент – цветы липы, ромашка (1:1), вспомогательные компоненты - черная смородина, календула)
•Для дыхательных путей (основной компонент – чабрец, календула (1:1), вспомогательные компоненты -ромашка, липа, цедра лимона, плоды шиповника)
•Седативный чай (основной компонент – ромашка,вспомогательные компоненты -плоды боярышника, цедра лимона)
•Сердечный чай (основной компонент – черная смородина, плоды боярышника (1:1),вспомогательные компоненты -черноплодной рябины, клюквы)
•Поливитаминный чай (основной компонент – плоды шиповника, вспомогательные компоненты -черноплодной рябины, клюквы, черной смородины, цедра лимона, цедра апельсина, яблоко).
Выводы:
1. Основные классы флавоноидов, которые удается разделить бумажной хроматографией: флаванолы, флаваноны, флавоны, халконы, ауроны.
2. Общее количественное содержание флавоноидов выше в спиртовых экстрактах, это свидетельствует о лучшей экстракции флавоноидов органическими растворителями.
3. Наибольшее содержание флавоноидов было установлено в чабреце, черноплодной рябине, календуле и цветках липы.
4. Предложена рецептура травяных чаев для учащихся с выявленными хроническими заболеваниями.
Библиографическая ссылка
Трубников И.С. СОДЕРЖАНИЕ ФЛАВОНОИДОВ В РАСТИТЕЛЬНОМ СЫРЬЕ И ИХ РОЛЬ В УКРЕПЛЕНИИ ЗДОРОВЬЯ // Старт в науке. 2023. № 3. ;URL: https://science-start.ru/ru/article/view?id=2313 (дата обращения: 05.02.2026).
