Введение.
Кристаллы играли и играют до сих пор немаловажную роль в природе и жизни человека. Практически все горные породы состоят из разных кристаллов. Лишь небольшое количество из них имеют состав, соответствующий чистому веществу, так как в природе все вещества непрерывно смешиваются под воздействием ветра, воды и других факторов.
В прошлом году я подготовила проект, в котором вырастила в лаборатории кристаллы из чистых солей. Мне удалось вырастить удивительные по красоте кристаллы. Они различались по цвету, форме, хрупкости и скорости образования. Мне очень понравилось выращивать кристаллы, наблюдать, как они растут и я задалась вопросом: получатся ли кристаллы, если смешать разные соли? Какой формы и какого цвета вырастут такие кристаллы?
Меня очень заинтересовала эта тема, и я поставила цель в своем новом исследовании вырастить кристаллы из смеси двух солей. Моя гипотеза: при соблюдении одинаковых условий выращивания из разных солей вырастают кристаллы разного цвета, формы и размера. А при смешивании разных солей, некоторые из них взаимодействуют друг с другом и дают новую форму кристаллов, а некоторые нет.
Для достижения этой цели, я поставила следующие задачи:
· найти в литературе и изучить информацию о кристаллах, о смеси кристаллов, о выращивании кристаллов из соли в лабораторных или домашних условиях;
· изучить необходимые меры безопасности и соблюдать их при проведении эксперимента;
· подобрать оборудование и соль для выращивания кристаллов в школьной лаборатории;
· вырастить кристаллы из смеси двух солей, одной из которых является поваренная соль;
· рассмотреть их, описать их форму, сфотографировать;
· проанализировать полученные результаты, сделать выводы.
В качестве объектов исследования я взяла кристаллы смеси двух солей, а в качестве предмета исследования – процесс кристаллизации.
Практическое значение моей работы: полученные умения и навыки могут быть использованы на уроках окружающего мира, во внеклассных мероприятиях, полученная небольшая коллекция может служить наглядным пособием.
Краткие сведения о кристаллах.
Криста?ллы (от греч. κρ?σταλλος первоначально — «лёд», в дальнейшем — «горный хрусталь; кристалл») — твёрдые тела, в которых частицы (атомы и молекулы) расположены закономерно, образуя трёхмерно-периодическую пространственную укладку — кристаллическую решётку.
Кристаллы распространены в природе, их можно получить и в лаборатории. Например, снежинки, морозные узоры на стеклах окон и иней, украшающий зимой голые ветки деревьев.
Большинство природных кристаллов имеют гладкие грани; грани кристаллов оптически плоские и обычно дают чёткие отражения окружения (как в оконном стекле). Плоские грани у кристаллов свидетельствуют о правильности внутреннего расположения атомов.
Кристаллы, которые, встречаются в природе, не являются чистым веществом и имеют различные примеси, которые могут понижать симметрию кристаллической решетки, давать шероховатые грани, кристалл может иметь не правильную форму: кристалл будет непрозрачный или ограниченно прозрачный. У природных кристаллов отражения бывают более размытыми и, следовательно, сами грани не идеально плоские. Условия, в которых растут кристаллы, имеют решающее значение для формы их образования. Такие факторы, как изменения температуры, тесное окружение соседними твердыми телами, иногда не позволяют растущему кристаллу приобрести характерную для него форму.
Заметной вехой в истории кристаллографии явилась книга, написанная в 1784 французским аббатом Р. Гаюи. Он выдвинул предположение, что кристаллы возникают в результате правильной укладки крохотных одинаковых частиц, которые он назвал «молекулярными блоками». Гаюи показал, каким образом можно получить гладкие плоские грани кальцита, укладывая такие «кирпичики». Примерный механизм роста кристалла можно представить в виде схемы, которая представлена на рисунке 1.
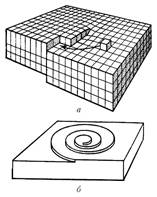
Рисунок 1. Схемы роста кристаллов: а) укладывание «молекулярных блоков», б) спиральный рост кристаллов.
Если в растворе находятся одновременно две соли, то они могут реагировать друг с другом, образуя малорастворимое вещество. Тогда его кристаллы, выпадая из раствора, будут образовывать растущий кристалл другой формы чем кристаллы солей, которые были растворены изначально.Особенности выращивания кристаллов.
Кристаллы мо
гут расти как в природе, так и в искусственных условиях. В соляных озёрах, на мелководье морей и заливов вода, нагреваясь, испаряется. Соль, растворенная в воде, выпадает в осадок, оседая на дне, на камнях и т.д. Так образуются солончаки, чаще они являются дном высохших озёр.
В искусственных условиях кристаллы выращивают из раствора или из расплава. Опыты по выращиванию искусственных кристаллов начинались еще в древности, со времен алхимиков. Изначально они преследовали другие цели: получение философского камня, обогащения, получения идеального кристалла и так далее.
Особенности выращивания кристаллов в лаборатории строятся на том, что соли имеют различную растворимость и этот показатель растворимости меняется при изменении температуры (при понижении температуры растворимость уменьшается, а при повышении температуры растворимость увеличивается). Например, медный купорос (CuSO4) можно растворить при 30 градусов всего около 25 г на 100 мл воды, но если повысить температуру до 80 градусов его растворимость увеличивается до примерно 55 г на 100 мл.
Кристаллизация соли наступает из-за падения температуры, потому что уменьшается растворимость соли. Также кристаллизация происходит из-за выпаривания воды из раствора соли. Получается, что для растворения соли не хватает воды, в которой она растворена, и, следовательно, соль будет оседать на дно стакана или, другими словами, кристаллизоваться.
Порядок проведения эксперимента.
Все этапы моего эксперимента сопровождали взрослые – руководитель моего проекта Макаренкова Г.Ю., а при выращивании кристаллов дома – моя мама Алена. Они помогали мне и контролировали на некоторых процессах. Я строго соблюдала правила безопасности при проведении экспериментов.
Для выращивания кристаллов я взяла окрашенные соли (названия приведу ниже) и растворяла их напополам с поваренной солью (по массе). Все массы отмеряла при помощи лабораторных электронных весов, а количество воды примерно, при помощи меток на химических стаканах.
Выращивание всех кристаллов проходило в одинаковых условиях для того, чтобы убедится, что форма кристаллов не зависит от условий проведения эксперимента.
Я придерживалась следующего порядка действий:
· Взять чистую посуду – химические стаканы из стекла на 150-200 мл и емкости из пластика объёмом 300-500 мл;
· Насыпать в химический стакан соли 10 г, в тот же стакан досыпать поваренной соли 10 г;
· Долить при помощи взрослых горячей воды, лучше кипятка (чтобы как можно больше соли растворилось), размешать соль стеклянной палочкой до полного растворения;
· Досыпать смеси соли 1:1 (соль и поваренную соль) понемногу, периодически помешивая и измельчая палочкой соль, до тех пор, пока она перестанет растворяться в горячей воде;
· Уложить на дно чистой пластиковой емкости чистые камни, перелить при помощи взрослых горячий раствор из химического стакана в пластиковую емкость;
· Оставить на длительное время для кристаллизации, при этом соли начнут оседать на стенках, дне и внесенных камешках в виде мелких кристалликов;
· Вынуть готовые кристаллы из раствора при помощи пинцета, высушить салфетками;
· Рассмотреть при помощи лупы, сфотографировать;
· Сравнить с результатами моего прошлого проекта.
Очень важные детали, на которые важно обращать внимание:
· Посуда для эксперимента должна быть чистой. Раствор соли готовится именно в заданном соотношении.
· Чем выше температура воды, тем быстрее в ней растворяются соли.
· Надо сразу определите место, где ёмкость с раствором сможет безопасно стоять долгое время. Также это место должно находиться подальше от батареи.
· Надо запастись терпением. Кристаллизация – процесс длительный, занимающий от нескольких дней до двух-трёх недель.
· Когда кристалл вырастит, можно покрыть лаком — он защитит изделие от белого налета при хранении и придаст ему блеск.
Для выращивания кристаллов я брала следующие соли:
· медь уксуснокислая или ацетат меди (Сu(CH3COO)2);
· медный купорос или сульфат меди (CuSO4);
· никелевый купорос или сульфат никеля (NiSO4);
· сода кальциевая или карбонат калия (К2СО3);
· кобальт уксуснокислый или ацетат кобальта (Со(CH3COO)2);
· аммоний азотнокислый (NH4NO3);
· калий йодистый или йодид калия (KI);
· железоаммонийные квасцы NH?Fe(SO?)?·12H?O.
Ко всем солям я добавляла поваренную соль или хлорид натрия (NaCl), массы были одинаковые – по 10 г соли и поваренной соли. Мне удалось вырастить удивительные по красоте кристаллы.
Рост кристаллов на каменной основе во всех растворах начался примерно через два-три дня. Через неделю их можно было рассмотреть и даже достать из раствора с помощью пинцета. Мы практически не тревожили кристаллы, не передвигали емкости, чтобы не нарушить рост кристаллов. Кристаллы становились больше с испарением воды.
Кристаллы росли не только на каменной основе, но и на стенках емкости и на дне. Рост кристаллов прекратился только тогда, когда вся вода испарилась. После этого мы сфотографировали полученные кристаллы.
Результаты эксперимента.
Растворы, которые мы оставляли для кристаллизации, представлены на рисунке 2.

Рисунок 2. Готовые растворы оставили для кристаллизации.
Фотографии выращенных кристаллов, которые мы делали в ходе эксперимента, представлены на рисунках далее по тексту. Фотографии некоторых кристаллов представлены в сравнении с кристаллами чистого вещества, которые я выращивала в прошлом году.
Медь уксуснокислая и Медь уксуснокислая и поваренная соль.
Фотографии готовых кристаллов представлены на рисунках 3-5. Рассмотрев кристаллы, мы обратили внимание, что кристаллы чистого вещества имеют правильную форму, также они твердые, темного сине-зеленого цвета, некоторые из них полупрозрачные. Кристаллы, выращенные из смеси солей напоминают по форме кораллы или облачка. На фотографии 5 можно видеть кристаллы поваренной соли и ацетата натрия, подкрашенные уксуснокислой меди, также отдельно (в основном на дне) кубические кристаллы поваренной соли и отдельные кристаллы уксуснокислой меди (темные кристаллы-вкрапления).
Никелевый купорос или сульфат никеля.
Кристалл растет не так быстро как остальные соли, имеет более темную окраску и форму усеченной пирамиды. Фотографии готовых кристаллов представлены на рисунках 6-7.
|
|
|
|
Рисунок 3. Полученные разнообразные кристаллы уксуснокислой меди в емкости, на дне, стенках и каменной основе. |
Рисунок 4. Монокристаллы уксуснокислой меди вблизи. |
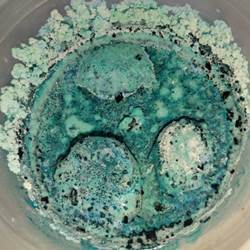
Рисунок 5. Полученные разнообразные кристаллы из смеси солей уксуснокислой меди и поваренной соли в емкости, на дне, стенках и каменной основе.
Можно отметить, что кристаллы чистого вещества выраженно игольчатой формы, тогда как форма кристаллов из смеси солей имеет сглаженные края, округлую форму, как будто оплавленные края. Имеется переход цвета (подкрашенные кристаллы). Скорее всего, из раствора выпали также кристаллы и сульфата натрия, и хлорида никеля.
|
|
|
|
Рисунок 6. Кристаллы никелевого купороса (проект прошлого года). |
Рисунок 7. Полученные разнообразные кристаллы из смеси солей никелевого купороса и поваренной соли в емкости, на дне, стенках и каменной основе. |
Сода и поваренная соль.
Кристаллы чистой соды оказались нестойкими, хрупкими, покрывались белым налетом, разрушались. Кристаллы смеси солей оказались более прочными. Они похожи на белые облачка. На дне емкости в смеси солей можно также рассмотреть отдельные кристаллы поваренной соли – они кубической формы. Фотографии представлены на рисунках 8-9.
|
|
|
|
Рисунок 8. Кристаллы соды (проект прошлого года). |
Рисунок 9. Полученные разнообразные кристаллы из смеси солей соды и поваренной соли в емкости, на дне, стенках и каменной основе. |
Калий йодистый и поваренная соль. и Аммоний азотнокислый и поваренная соль.
Эти два эксперимента не удались, так как обособленных больших кристаллов получить не удалось. Соль осела в виде желтоватой и бело-кремовой пленки на дне, каменной основе и стенках емкости. Кристаллы очень мелкие, плохо различимы, невзрачные. Виден переход цвета, кристаллы разной формы.
Железоаммонийные квасцы и поваренная соль.
При приготовлении раствора этой соли совместно с поваренной солью раствор помутнел, и я думала, что ничего не выйдет, но все же оставила его для кристаллизации. Скорее всего, в растворе между веществами произошла реакция обмена и в итоге выросли совместно кристаллы поваренной соли, сульфата аммония, хлорида аммония, сульфата железа и сульфата натрия.
Фотография готовых кристаллов представлена на рисунке 10.
Медный купорос и поваренная соль.
Раствор чистого медного купороса синего цвета. При растворении смеси солей (с поваренной солью), он приобретает светло-зелёный цвет. При испарении воды образуются необычные светло-зелёные кристаллы необыкновенной формы, похожие на зелёные кустики. Точно также как описано выше, происходит реакция обмена и вырастают кристаллы четырех разных солей: сернокислой меди, сернокислого натрия, хлорида натрия и хлорида меди. Фотографии кристаллов представлены на рисунке 11-13.
|
|
|
|
Рисунок 10. Кристаллы из смеси солей железоаммонийных квасцов и поваренной соли. |
Рисунок 11. Кристаллы медного купороса (проект прошлого года). |
|
|
|
|
Рисунок 12. Кристаллы смеси различных солей, похожи на зеленые кустики. |
Рисунок 13. Кристаллы из смеси солей медного купороса и поваренной соли (смесь различных кристаллов). |
Уксуснокислый кобальт и поваренная соль.
Раствор получился тёмно-розового цвета. Кристаллы из смеси с поваренной солью выросли похожие на тёмно-розовые водоросли. Можно заметить отдельные кристаллы как поваренной соли (прозрачные мелкие кубики) и мелкие игольчатые кристаллы уксуснокислого кобальта. Фотографии кристаллов представлены на рисунках 14-15.
|
|
|
|
Рисунок 14. Кристаллы уксуснокислого кобальта (проект прошлого года).
|
Рисунок 15. Кристаллы из смеси солей уксуснокислого кобальта и поваренной соли. Видны кристаллы разной формы |
Выводы по результатам работы.
Делая опыты, я пришла к следующим выводам:
· Кристалл можно вырастить, используя насыщенный раствор соли;
· Горячая вода способна растворять большее количество соли, поэтому при охлаждении соль, которая не может растворяться выпадает из раствора и начинает образовывать кристалл;
· Для того, чтобы кристалл начал формироваться, необходима площадка или поверхность. Я использовала камни, но в большинстве случаях кристаллы росли также на стенках емкостей;
· Кристаллы растут разное время;
· Разные соли образуют кристаллы, даже если выращивать их в одинаковых условиях;
· Соли, смешиваясь друг с другом способны образовывать кристаллы различной формы, вырастая как совместно, так и параллельно, рядом;
· Кристаллы, выросшие из смеси солей, чаще всего не похожие по форме на кристаллы этих же солей в чистом виде;
· Часто в растворах солей происходят реакции обмена и вместо двух солей при кристаллизации образуются четыре разных соли;
· Окрашенные соли способны подкрашивать прозрачные кристаллы поваренной соли или белую соль сульфата натрия, образуя различные оттенки и переход цветов (размытость цвета);
· Кристаллы чистого вещества отличаются удивительной правильностью и точностью строения, одинакового в любой его части. В то время как кристаллы смеси солей образуют причудливые формы, похожи на живые растения или кораллы, имеют переливы цвета;
· Кристаллы очень красивы, они завораживают, хочется их держать в руках, рассматривать бесконечно и кажется, что я могу создавать красоту.
Заключение.
Природные кристаллы всегда вызывали любопытство у людей. С кристаллами были связаны разные суеверия. Позднее, когда те же самые минералы стали разрезать и полировать, как драгоценные камни, многие суеверия сохранились в талисманах «на счастье» и «своих камнях», соответствующих месяцу рождения.
Сегодня же кристаллы, помимо их свойства соблазна, нашли очень большое применение в науке и технике: полупроводники, призмы и линзы для оптических приборов, твердотельные лазеры, оптические и электрооптические кристаллы, ферромагнетики и ферриты, монокристаллы металлов высокой чистоты и другие.
Из кристаллов различных солей и их смесей образованы горные породы нашей земли. Так как в природе практически не бывает чистого вещества, то так или иначе различные кристаллы имеют примеси и образуются совместно. Очень распространенная соль на земле это хлорид натрия или поваренная соль. Мне стало интересно, как изменится форма кристалла, если при его образовании в смесь попадет поваренная соль. Вырастут ли кристаллы различных солей независимо друг от друга или вместе образуют один кристалл?
В моей работе я вырастила кристаллы разной формы и цвета из смесей различных солей с поваренной солью и открыла для себя этот удивительный мир кристаллов. Я рассмотрела вопрос о том, как растут кристаллы в природе и как можно вырастить их в школьной лаборатории или в домашних условиях. Изменяя виды соли для выращивания можно получить кристаллы разной формы, что было подтверждено экспериментально.
Библиографическая ссылка
Миняйленко М.Д. НЕОБЫЧНЫЕ КРИСТАЛЛЫ ИЗ СМЕСИ СОЛЕЙ // Старт в науке. 2022. № 4. ;URL: https://science-start.ru/ru/article/view?id=2216 (дата обращения: 05.03.2026).