Есть ещё одно замечательное вещество, без которого жить нельзя, – кислород (он обозначается символом О в таблице Менделеева). Этот газ, молекула которого состоит из двух атомов кислорода (02), – без цвета и без запаха. Кстати, то, что кислород невидим, безвкусен, лишён запаха и газообразен при обычных условиях, надолго задержало его открытие. Кислород нашли и распознали лишь в восемнадцатом веке благодаря стараниям выдающихся химиков Джозефа Пристли, Карла Вильгельма Шееле и Антуана Лорана Лавуазье.
Итак, кислород мы не видим и не чувствуем, хотя в воздухе, которым мы дышим, его много – почти 21 % по объёму, пятая часть. (Остальное приходится на азот с небольшой примесью углекислого газа.) Но мы прекрасно чувствуем его отсутствие. Если в комнате душно, мы просим открыть окно, чтобы впустить свежий воздух, – дышать же нечем!
А зачем нам кислород? Вдыхая порцию свежего воздуха, мы посылаем кислород в лёгкие. В них он впитывается в кровь, где его уже поджидает специальное транспортное средство под названием «гемоглобин», и на этом скоростном такси кислород доставляется во все органы, ткани и клетки, из которых сложен наш организм. Каждая крошечная живая клетка, а их в нашем теле сто тысяч миллиардов (!) – это маленький химический реактор, где вещества непрерывно взаимодействуют друг с другом, превращаясь в то, что нужно нашему организму. Каждую секунду, без остановки на сон и обед, в нашем теле незаметно протекают миллиарды реакций, благодаря которым мы и живём. О том, что все эти реакции происходят в воде, мы уже говорили. Так вот, кислород – главное действующее лицо в этих превращениях.
С его участием протекают разнообразные реакции окисления, в которых «сгорают» вещества, поступающие с пищей в наш организм. А в результате выделяется много энергии – той самой, которую мы используем, чтобы двигаться и поддерживать постоянной температуру нашего тела, 36,6 градусов. Правда, в таких реакциях всегда выделяется диоксид углерода (С02). Но, к счастью, мы умеем легко избавляться от него, выдыхая его в атмосферу. [3].
Цель работы: изучение невидимого газа кислорода.
Задачи: выяснить источник пополнения кислорода на Земле (эксперимент «Фабрика питания»); выделить кислород из перекиси водорода; выяснить, почему срез яблока на воздухе темнеет, а металл ржавеет; определить, почему костер трещит; познакомиться с «активным кислородом»; научиться делать кислородный коктейль и выяснить его влияние на организм человека; определить допустимый уровень кислорода в крови.
Кислород – чрезвычайно активное вещество
Кислород так и ищет, с кем бы ему соединиться и что бы ему разрушить. Поэтому кислород вездесущ. Этот элемент присутствует в подавляющем большинстве веществ, из которых сделан мир, и мы сами. Он есть в воде, в песке, глине и почти во всех минералах. В большинстве веществ, из которых сделано всё живое (химики называют их органическими веществами), во всём, что мы едим и носим, обязательно есть кислород.
Кислород никогда не успокаивается. Чтобы ни подвернулось ему под руку, он первым делом пытается окислить «собеседника». Чаще всего ему это удается. Попалась железная крыша, и он начинает работать, превращая железо в ржавчину – соединения железа с кислородом. Правда, в случае с железом это долгий процесс. Но бывают быстрые, почти мгновенные реакции окисления.
А горение? Это тоже реакция окисления с участием кислорода. Быстрая, красивая, но и опасная. При реакциях окисления выделяется тепло, благодаря которому можно погреться у костра или камина. Преющее сено, в котором происходит медленное окисление, становится теплым. Да и перегной, который на дачах кладут в парники, тоже разогревается от окисления и согревает растения. Но ведь и до пожара недалеко.
Поэтому очень полезный и необходимый для жизни кислород бывает и опасен, и вреден. Вот почему химики придумали разные вещества, которые защищают от этого агрессора. Их вводят в состав материалов, чтобы они не горели и не окислялись, чтобы дольше служили. Наш организм тоже придумал свою внутреннюю защиту от неуёмного кислорода. Бывают случаи, когда его надо сдерживать. Вот на эти случаи и есть вещества, называемые антиоксидантами, которые тормозят реакции окисления в наших клетках. Очень много таких веществ содержится, например, в зелёном чае. Поэтому люди, заботящиеся о своем здоровье, пьют именно его.
Вообще, долгое пребывание в чистом кислороде приводит к смерти: об этом писали еще Пристли, Шееле и Лавуазье. Мыши в кислороде гибнут через три-пять дней, а болезненные изменения в их организме начинаются уже в первые часы. Так что относительно небольшое содержание кислорода в воздухе, точно рассчитанное природой, – это оптимум, отклоняться от которого не стоит [3].
Откуда берется кислород?
В самом деле, откуда берётся кислород? Он же непрерывно расходуется на дыхание и окисление всего? А его количество в воздухе как будто и не уменьшается. Так и есть, и всё благодаря очередному химическому чуду, сотворённому природой.
Всё дело в растениях и водорослях. Они не едят борщ, котлеты с картошкой и компот. У них своя еда – вода, воздух и... свет. Они берут воду из почвы, из лужи или океана. Они всасывают через свои зелёные листочки и клетки диоксид углерода, которого много в атмосфере, потому что это главный продукт любой реакции окисления. Они улавливают солнечные лучи. А дальше начинается великое таинство под названием «фотосинтез». Из этих незамысловатых компонентов, то есть всего лишь из трёх элементов – водорода, кислорода и углерода, содержащихся в воде и диоксиде углерода, – растения в своих клеточках синтезируют величайшее множество самых разных органических соединений. Ведь из атомов водорода, кислорода и углерода, взятых в любом количестве, можно составить бесконечное количество комбинаций. Так получаются вещества, из которых состоят сами растения. Они позволяют им расти, цвести и размножаться.
А что же кислород? В результате этих реакций растения выделяют в атмосферу кислород, чистейший и самый настоящий. «А разве самим растениям кислород не нужен?» – спросите вы. Нужен, обязательно нужен. Мы же знаем, что большинство реакций в живых организмах (а растения конечно же живые!) протекают с участием кислорода. Поэтому часть кислорода, который растения производят, они расходуют на свои нужды, на своё собственное «дыхание», а остальное отдают в атмосферу, чтобы все другие живые существа тоже могли дышать. Арифметика тут такая: на собственные нужды растения тратят лишь одну седьмую часть произведённого ими кислорода. Причём подавляющую часть этого вещества (80 %) в атмосферу поставляют одноклеточные водоросли, живущие в океане, и лишь пятую часть (20 %) – растения, живущие на земле. Вот почему океан и леса называют лёгкими нашей планеты.
Откуда мы всё это знаем? Ещё до того, как химики придумали разные приборы, позволяющие находить кислород где угодно и измерять его количество, они уже установили, что растения умеют производить этот волшебный газ. Один из первооткрывателей кислорода Джозеф Пристли поместил зелёную ветку мяты под стеклянный колпак с воздухом, в котором горела и потухла свеча. И оказалось, что живая зелёная ветка возвращает воздуху под колпаком способность поддерживать горение свечи.
А ночью, когда нет света, фотосинтез останавливается? Да, останавливается. Поэтому ночью растения дышат тем кислородом, который есть в атмосфере. А водоросли дышат ночью тем кислородом, который растворён в воде,- в среде их обитания. Кислород не то чтобы очень хорошо растворяется в воде, всего лишь сотая часть того, что находится в атмосфере, может поглотиться водой. Но этого вполне достаточно, чтобы поддерживать жизнь в водоёмах.
Между прочим, наименее требователен к кислороду карась, он спокойно живёт в заросших прудах, где почти весь растворённый в воде кислород расходуется на окисление органических веществ. Карп куда более привередлив, ему нужно, чтобы в литре воды содержалось не меньше четырёх миллиграммов кислорода. Но больше всего кислорода требуется рыбам, обитающим в быстрых реках, особенно горных, например, форели. Им же приходится частенько плыть против течения, то есть тратить много энергии. А эту энергию в своих телах они получают благодаря реакциям окисления.
В мировом океане содержание растворенного О2 больше в холодной воде, а меньше в теплой. [3].
А нужен ли нам чистый кислород?
Да, чистый кислород нам нужен для многих и очень важных дел. Больному, который задыхается, надо немедленно дать кислородную подушку. А чем её заполнить? Чистым кислородом. Он нужен и на самолётах на случай разгерметизации, и на подводных лодках для восполнения убыли кислорода, чтобы экипаж мог свободно дышать каждую минуту.
Кислород нужен и в промышленности. Благодаря ему можно поддерживать высокую температуру горения в домнах или печах, где выплавляют металл. Он необходим на тех производствах, где продукцию получают с помощью реакций-окисления. В общем, чистого кислорода нужно много.
Как же его получить? Химикам известно множество разных способов. Например, можно пропустить электрический ток через воду, и ее молекулы разложатся на составные части – водород и кислород. Или взять вещество, которое химики мудрёно называют перманганатом калия, а бабушка и мама попросту марганцовкой. Оно наверняка есть в вашей домашней аптечке – пузырёк с темно-фиолетовыми, почти чёрными мелкими кристалликами. Если его нагреть, то в результате будет выделяться чистый кислород.
Или другое вещество из той же аптечки – перекись водорода. Она, как и вода, сложена из атомов водорода и кислорода, только в ней на два атома водорода приходится не один, а два атома кислорода. Перекись водорода – относительно неустойчивое соединение и постепенно разлагается, превращаясь в воду и выбрасывая «лишний» кислород. Но этот процесс можно ускорить, например, бросив в кружку, в которую вылили пузырёк перекиси, несколько небольших кусочков сырых овощей. Жидкость в кружке буквально вскипает от выделяющихся пузырьков чистого кислорода. То же самое происходит, когда мама смачивает перекисью вашу разбитую коленку. В этом случае разложение перекиси водорода ускоряют вещества, содержащиеся в вашей крови. А выделяющийся, очень активный кислород убивает все микробы, которые могли лопасть в рану из земли.
Но все эти способы хороши для лабораторных экспериментов или бытовых нужд. А вот для получения больших количеств кислорода нужно что-то другое, какая-то простая и дешевая технология.
Эту технологию придумал в тридцатые годы прошлого века великий русский физик Пётр Леонидович Капица. Он сконструировал аппарат, который позволял сильно охлаждать (до минус 196 градусов) и сдавливать воздух, в результате чего тот становился жидким, а потом эту жидкость разделять на ручейки чистейшего кислорода и азота. Струя жидкого кислорода и вправду похожа на ручей, потому что она прозрачная и голубоватого цвета. [3].
Бывают ли живые организмы, которые не нуждаются в кислороде?
Да, бывают. Такие организмы называются анаэробными (греч. «ан» – отсутствие, «аэр» – воздух), в противоположность аэробам – тем организмам, которые не могут жить без кислорода. К анаэробам относятся организмы, которые живут в среде, лишенной кислорода – многие бактерии, некоторые грибы, водоросли и некоторые животные, например, практически все гельминты (т. е. глисты – паразитные черви). Часть анаэробов умеет «переключаться» с анаэробного типа дыхания на аэробный – они называются факультативными анаэробами; а часть вообще не переносит кислорода, погибает от его присутствия – это облигатные анаэробы (например, возбудитель столбняка – столбнячная палочка).
С процессами анаэробного дыхания знаком каждый из нас! Так, брожение теста или кваса – это пример анаэробного процесса, осуществляемого дрожжами: они окисляют глюкозу до этанола (спирта); процесс скисания молока – это результат работы молочнокислых бактерий, которые осуществляют молочнокислое брожение – превращают молочный сахар лактозу в молочную кислоту. [4].
Получение и применение кислорода.
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 Мп.
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров – устройств для сжижения и разделения жидкого воздуха.
Кислород очень реактивный элемент, который легко образует такие соединения, как оксиды.
Жидкий кислород используется в ракетном топливе.
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива, включая пороха, для горения которых не нужен кислород воздуха: в процесс е горения таких веществ кислород выделяется из них самих.
Любое пористое горючее вещество, например, опилки, будучи пропитанными голубоватой холодной жидкостью – жидким кислородом, становится взрывчатым веществом. Такие вещества в случае необходимости могут заменить динамит при разработке рудных месторождений.
Применяется как реагент в химической технологии (обжиг сульфидных руд, синтез оксидов), металлургии (производство чугуна и стали), газификации природного угля, сварке и резке металлов. Жидкий кислород – окислитель топлива в ракетной технике. [5].
Несколько интересных фактов о кислороде
Содержание кислорода в современной атмосфере – 21 %. В крупных городах количество кислорода в воздухе может снижаться до 17-18 %, а при неблагоприятных метеорологических условиях до 12-15 %. В мегаполюсе мы дышим не кислородом, а оксидом углерода, виноваты в этом автомобильные выхлопы, состоящие в основном из угарного газа. Ежедневно от 75 до 85 млн автомобилей выбрасывают в атмосферу Земли загрязняющие вещества.
В воздухе городских помещений кислорода меньше, чем необходимо: в офисах и квартирах содержание кислорода не превышает 20 %, а организму требуется не менее 21,3 %. Человек начинает ощущать недостаток кислорода при его снижении в атмосфере до 18 %, а критическими для жизни являются 7 %.
За сутки человек потребляет 400-500 литров кислорода, делая 12-20 вдохов и выдохов в минуту. Без кислорода человек может прожить всего несколько минут. Мозг может жить в течение 4-6 минут без кислорода, а затем начинает умирать. Нехватка кислорода от 5 до 10 минут может привести к необратимым повреждениям мозга.
Убыль кислорода в атмосфере в результате процессов горения, гниения и дыхания возмещается растениями при фотосинтезе. При вдыхании воздуха в легкие человека и животных кислород связывается с гемоглобином крови и переносится в клетки, где органические вещества (в первую очередь глюкоза) с его помощью окисляются и обеспечивают жизненную энергию организмов. [9].
Методы и результаты экспериментов
Эксперимент № 1. «Фабрика питания» [№ 1]
Черенки бегонии заранее укоренили, и посадили в горшки. Почву полили. Внутрь небольшого аквариума поместили один горшок с растением, герметично закрыли крышкой, поставили в светлое теплое место. Другой оставили на подоконнике, периодически поливали. В течение месяца наблюдали за растениями. Спустя месяц наше растение в герметичной емкости не погибло, а наоборот даже подросло, на стенках емкости периодически появлялись капли воды, потом исчезали. Сделали вывод – растение кормит само себя и для дыхания может обеспечить себя кислородом.
Эксперимент № 2. «Выделение кислорода из перекиси водорода и катализатора» [№ 2]
Вот один из самых простых способ получения кислорода в лабораторных условиях. Использование перекиси водорода. Перекись водорода, пероксид, гидроперит – всё одно и то же вещество. Перекись водорода продаётся в таблетках и в виде растворов (3 %, 5 %, 10 %), которое можно приобрести в аптеке. Перекись водорода – неустойчивое вещество. Уже при наличии света она начинает распадаться на кислород и воду. Поэтому в аптеках перекись продаётся в пузырьках из тёмного стекла. Кроме того, быстрому разложению перекиси водорода на воду и кислород способствуют катализаторы, например, оксид марганца, активированный уголь, стальной порошок (мелкая стружка) и даже слюна. Поэтому, перекись водорода нагревать не нужно, достаточно катализатора!
Катализатор – вещество, которое не расходуется при химической реакции, а лишь ускоряет её.
При контакте с катализаторами перекись водорода разлагается с выделением кислорода. Отсюда ее противомикробное и обесцвечивающее действие. Если обработать перекисью свежую рану фермент крови начнет расщепляет перекись водорода на воду и активный кислород, который надежно обеззараживает рану. Однако действие перекиси водорода кратковременно, поэтому, остановив кровотечение, надо перевязать рану. Для эксперимента мы взяли небольшой стакан, перекись водорода и несколко капель крови. Капнув кровь в перекись началась мгновенноя реакция с выделением кислорода и тепла. Из стакана поднялась пена, а сам стакан немного нагрелся! [2].
Эксперимент № 3. Почему срез яблока на воздухе темнеет? [№ 3]
Многие дети любят, поесть свежие наливные яблоки. Особенно яблоки, которые были нарезаны на аппетитные кусочки. К сожалению, часто бывает, что плоть яблока быстро становится коричневого цвета. Это, в свою очередь, многие дети не любят.
Что происходит в этом потемнение? Если разрезать яблоко, клетки в месте его среза будут уничтожены. В этих клетках, существуют различные вещества, в том числе так называемые полифенолы и некоторые ферменты. Полифенолы в контакте с воздухом, в котором также содержится кислород, образуют химическую реакцию – окисление. Ферменты из клеток, таким образом, ускоряют этот процесс. И полифенолы образуют коричневые пигменты. Кстати: Полифенолы относятся к фитохимическим веществам и очень полезны! Обесцвечивание на границе среза происходит у груш, бананов и на картофеле. Есть сорта фруктов и овощей, на которых происходит более или менее значительное потемнение.
Окислившиеся срезы вредны? Нет. Разрезанные яблоки с потемневшими срезами можно смело есть. Можно ли предотвратить потемнение яблок на срезе? Да, можно. Например, если срез покрыть пленкой. Таким образом, кислород не вступит в реакцию с полифенолами. Еще один совет. Можно сбрызнуть срез лимонным соком. Лимонная кислота, содержащаяся в соке, обесцвечивает темный пигмент. Так делает наша мама, когда готовит фруктовый салат, что бы он не терял своей привлекательности. [10].
Эксперимент № 4. Почему костер трещит? [№ 4]
Мы наблюдали за небольшим костром и слышали от него треск. Из-за чего происходит треск? Когда огонь достаточно разгорелся, он начинает сильно хрустеть.С хрустом вокруг костра появляются искры. Почему появляется треск у горящего дерева? Есть два объяснения, которые могли бы быть одновременно правильным. Первое объяснение в том, что углерод газифицируется в древесине при более высоких температурах, его достигает воздух, акислород находящийся в составе воздуха реагирует со взрывом. Это и есть тот звук, который мы воспринимаем как треск. Второе объяснение в том, что вода, содержащаяся в клетках древесины, при нагревании расширяется, создается высокое давление до тех пор, пока клетки не лопаются, тем самым создавая акустический шум для нас. [11].
А может ли огонь гореть без кислорода? Знаете ли вы, что свеча может гореть под водой, если она имеет достаточное количество воздуха? Как долго горит пламя под водой?
Для эксперимента мы взяли: стеклянную чашу, стеклянный бокал, свеча, спички, вода.
Заполним миску водой, поставим в середину свечу и зажжем её. Возьмём прозрачный стакан. Перевернём его и поставим на свечу так что бы край стекла был на поверхности воды. Опустим стакан вниз до дна и немного подождём. Что происходит и почему?
Свеча горит пока есть постоянный приток кислорода. Воздух в стакане вытесняет воду. Таким образом, свеча продолжает гореть. Через некоторое время, пламя гаснет! Это происходит потому, что кислород в стакане закончился, а для горения огонь нуждается в кислороде! После того как кислород в банке исчезает, давление воздуха из нутри на воду уменьшается, и вода спокойно может подняться вверх на несколько сантиметров. [12].
Эксперимент № 5. «Активный кислород – отбеливатель» [№ 5]
Кислородным отбеливателем называют перкарбонат натрия, состоящий из кристаллов натуральной соды и перекиси водорода. Кислородный отбеливатель часто встречается в составе порошков и чистящих средств и представляет собой твердое порошкообразное вещество, которое перед использованием обычно растворяют в воде. При взаимодействии кислородного отбеливателя с водой происходит химическая реакция, при которой выделяется кислород. Кислородный отбеливатель часто используется для удаления пятен, так как пузырьки кислорода помогают расщеплять грязь, неприятные запахи и убивают микробов. Порошковый кислородный отбеливатель считается безвредным для окружающей среды, поскольку единственным его отходом является содовая зола – нетоксичное вещество, безопасное при растворении в водопроводе.
Кислородный отбеливатель разрушает загрязнения, окисляя их, тем самым, облегчая их последующее удаление, либо изменяя цвет участков молекул загрязнения, прочно связанных с волокнами на бесцветные или белые. Общеизвестна эффективность кислородных отбеливателей в удалении цветных пятен растительного происхождения, таких как кофе, трава, чай, пятна соков, фруктов, чернил, парфюмерных веществ и других окрашенных загрязнений растительного происхождения и продуктов их содержащих. В результате происходит усиление моющего действия, как за счет обесцвечивания и удаления окрашенных загрязнений, так, и за счет облегчения удаления неокрашенных загрязнений. Отбеливатель активируется при соприкосновении с водой. Средство эффективно при температуре выше 50С, наибольший эффект достигается при температуре 70-90С. В нашем эксперименте мы используем отбеливатель немецкого производителя
СОДАСАН. Активным ингредиентом продукта является перкарбонат натрия. Отбеливатель не содержит ферментов или выделяющих хлор химических веществ.
Для наглядного опыта мы попробуем очистить, с помощью отбеливателя, от темного налета, небольшую эмалированную кастрюлю, в которой много раз варилась гречневая каша. Дно и края кастрюли потемнели, покрылись биологическим налетом и вручную практически не отмывается.
Итак, у нас есть: одна кастрюля – 500 мл, две ложки кислородного отбеливателя и горячая вода.
Насыпаем порошок в кастрюлю, заливаем в нее горячую воду, аккуратно помешиваем. Наблюдаем. В процессе окисления происходит бурная реакция выделения кислорода, вода в кастрюле как будто кипит, но без огня! Ждем 15 минут. Выливаем воду, протираем кастрюлю губкой для мытья посуды. Кастрюля снова блестит как новая!
Эксперимент № 6. «Кислородный коктейль» [№ 6]
Кислородный коктейль – это пена, образующаяся при прохождении кислорода через фито раствор. Фито раствор – смесь пеносвязующего компонента и фито-компонента (отвары трав, сиропы, соки, витамины). Кислородный коктейль советуют нам применять как биологическую добавку для общего улучшения обменных процессов в организме, а также для лечения и профилактики различных заболеваний.
Для приготовления 8 стаканов коктейля нам потребовалось: 250 мл. теплого компота, 6 грамм порошковой композиции (состав: сухой яичный белок, пектин яблочный, экстракт шиповника, сахарная пудра), кислородный коктейлер, кислородный баллончик.
Приготовление. Засыпаем смесь для коктейля в коктейлер, аккуратно наливаем в него компот и тщательно перемешиваем смесь. Оставляем растворятся на 10 минут. Присоединяем кислородный баллончик к коктейлеру, нажимаем на клапан баллончика и наливаем коктейль в стакан! Кислородный коктейль – это очень вкусно, мы в этом убедились! Но действительно ли он так полезен и необходим нам?
Как таковой, кислородный коктейль не в состоянии нанести вред человеческому организму. Особенно, если перед его употреблением проконсультироваться с врачом и точно выяснить свои дозировки. Кислород из коктейля не усваивается нашим организмом. Поэтому всерьез бояться перенасыщения не стоит. Есть информация о том, что кислородные коктейли ни в коем случае не следует употреблять через коктейльную соломинку. Такой метод поедания (или выпивания) может привести к ожогу дыхательных путей. Кроме этого, употребление продукта через соломинку нередко влечет за собой резкое и болезненное вздутие живота. Употреблять подобную продукцию следует исключительно с ложки. Вред кислородный коктейль может принести в том случае, когда его готовят в антисанитарных условиях и не соблюдают при этом никакие рецептуры. Насыщают ли кислородные коктейли организм человека кислородом? Проглотив пену, мы прямым путем отправляем ее в желудочно-кишечный тракт, а оттуда никакой кислород никуда не всасывается.
В нашем организме существует только одна система, где кислород всасывается. Там двойная система кровоснабжения, низкая скорость кровотока, для того чтобы кислород успел прикрепиться к эритроциту, а эритроцит успел отдать углекислый газ.
Измерив после принятия кислородного коктейля пульсоксиметром насыщение крови кислородом наглядно, по цифрам, мы убедились, что никакого увеличения количества кислорода не произошло! Итак, мы выяснили, что кислородный коктейль не насыщает кровь кислородом. [6–8].
Эксперимент № 7. «Изучение влияния прогулок на насыщение крови кислородом»
Этот эксперимент мы проводили на свежем воздухе. Перед прогулкой измерили пульсоксиметром в течение 30 секунд уровень насыщения крови кислородом, отправились в лесопарк. Погуляв два часа на свежем воздухе, провели повторное измерение. Результаты представили в таблице.
Уровень насыщения артериальной крови кислородом – SpO2 (нормальные значения составляют 94-99 %)
|
Имя |
Уровень кислорода, % до прогулки |
Уровень кислорода, % |
|
Мама Марина 33 года |
96-97 |
98-99 |
|
Елена 15 лет |
98-97 |
99-98 |
|
Ольга 7 лет |
97-98 |
98-99 |
|
Екатерина 5 лет |
99-98 |
99 |
Эксперимент показал, что все мы здоровы!
Эксперимент № 8 «Коррозия металла» [№ 7].
Нам потребовались: очень мелкая стальная стружка, прозрачный стакан, пробирка, полоска картонная, блюдце, вода.
На смоченную водой картонную полоску равномерно насыпаем железную стружку. Помещаем полоску в пустую пробирку. Затем пробирку помещаем вверх дном в стакан в наклонном положении и наливаем в него немного воды. На второй день железо покрыватся ржавчиной. Железо постепенно ржавеет, причем в местах, где оно соприкасается с воздухом и водой, ржавление происходит быстрее.
Чтобы предотвратить процесс ржавления, железные изделия стараются изолировать от воды и воздуха, покрывая их слоем какого-либо устойчивого при обычных условиях металла: цинка (получают «оцинкованное железо») или олова («луженое железо»). Часто применяется и никелированное покрытие – покрытие тонким слоем никеля; используют и покрытие керамической эмалью. Чтобы предохранить изделия из железа от ржавчины, их можно также смазать жиром или покрыть краской. Эти способы защиты действуют до тех пор, пока не нарушена целостность покрытия. К таким вещам нужно относится особенно аккуратно и бережно. [1].
Выводы
Проведя целую серию экспериментов по изучению свойств кислорода, мы выяснили, что кислород – невидимый газ, который входит в состав воздуха, что кислород – необходимая составляющая для поддержания жизни на Земле. Мы смогли выделить кислород из перекиси водорода, познакомились с процессом окисления, определили, почему костер трещит, увидели активный кислород в работе, научились делать кислородный коктейль. Насытить организм кислородом можно только с помощью прямого поглощения кислорода кровью через легкие. С помощью кислородного коктейля это сделать невозможно, потому что наша пищеварительная система неспособна усваивать кислород. Если не относиться к кислородному коктейлю, как к источнику кислорода, то этот продукт хорош тем, что он – источник белка. Кислородный коктейль богат белком это мы видим из его состава. Чем можно заменить кислородный коктейль? Конечно молочным коктейлем! Если к кислородному коктейлю относиться, как к еде, то заменить его можно чем угодно. А если у вас дефицит кислорода, то отправляйтесь в лес на прогулку! Ведь пребывание на свежем воздухе способствует насыщению крови кислородом!
Так откуда же берется кислород в воздухе? Проведя эксперимент «Фабрика питания», мы определили, что, находясь в закрытом пространстве без доступа воздуха на свету и в тепле, наше растение прекрасно себя чувствует и даже растет! Зеленые растения – фабрики кислорода! Наша гипотеза подтвердилась!
Когда-то Якоб Берцелиус сказал: «Кислород – вещество, вокруг которого вращается вся земная химия». А Альберт Энштейн, что «Наука не является и никогда не будет являться законченной книгой». Мы только начали свои первые шаги в науку и обязательно их продолжим!
Приложение № 1

Фабрика питания
Приложение № 2
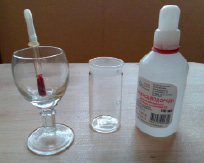

Выделение кислорода из перекиси водорода и катализатора
Приложение № 3

Окисление яблок
Приложение № 4



Почему костер трещит?
Приложение № 5


Активный кислород – отбеливатель
Приложение № 6




Кислородный коктейль
Приложение № 7



Коррозия металла
Библиографическая ссылка
Козлова О.А., Козлова Е.А. ИСТОЧНИК ЖИЗНИ– КИСЛОРОД // Старт в науке. 2018. № 6-2. ;URL: https://science-start.ru/ru/article/view?id=1316 (дата обращения: 12.02.2026).
