Первоначально разглядывание маленьких живых существ в микроскоп было своего рода забавой для пытливых умов. Прошло немало времени, прежде чем исследование бактерий было поставлено на научную основу. Благодаря этому ученые смогли связать наличие живых микроорганизмов с возникновением болезней и эпидемий [1].
В наши дни развитие науки вообще и медицины в частности уже невозможно представить без микробиологии. Серьезные научные исследования проводят в лабораториях на специальном оборудовании, но повторить некоторые опыты можно и в домашних условиях.
История вопроса

О существовании бактерий сейчас известно каждому ученику начальной школы, но так было далеко не всегда. Впервые изобрел микроскоп Захарий Янсен (1590г.), а увидеть бактерии смог ученый из Нидерландов Антони ван Левенгук в 1674 г.
Немного позже, в 1828 году, появилось название «бактерия» (от греч. «маленькая палочка»). Слово ввел в обиход немецкий ученый Христиан Эренберг. Еще позже француз Луи Пастер и немец Роберт Кох, продолжая работу по изучению микроорганизмов, связали возникновение болезней с наличием в организме человека или животного бактерий.
За создание бактериологической теории возникновения болезней Роберт Кох в 1905 году был награжден Нобелевской премией [7].
Актуальность работы
Исследование живых микроорганизмов необходимо для обнаружения возбудителя болезни в организме человека, животного или в окружающей среде. Микробиологическая лаборатория изучает бактерии, устанавливает их вид и проверяет на устойчивость к антимикробным препаратам [3].
Микробиологическое исследование необходимо не только для установления точного диагноза (анализы крови, мочи, кала, слизи), но и для определения безопасности для человека окружающей среды. Например, санитарно-эпидемиологическая служба в обязательном порядке исследует продукты, предназначенные для людей и животных.
Цель работы: Изучение влияния внешних факторов на рост выделенной группы микроорганизмов в домашних условиях.
Задачи работы:
1. Культивировать микроорганизмы, полученных в домашних условиях, и выделить чистую культуру.
2. Изучить влияние различных факторов внешней среды на рост чистой культуры.
3. Изучить и систематизировать полученные данные.
Методика работы
Изучая литературу и другие источники, определила среду для культивирования микроорганизмов. Данная работа проводится с использованием мясо-пептонного агара.
Мясопептонный агар (МПА) – это питательная среда для культивирования микроорганизмов, таких как энтеробактерии, синегнойная палочка, стафилококки. При необходимости среда может быть обогащена кровью, сывороткой, углеводами, солями. МПА представляет собой непрозрачный студень светло-коричневого цвета[2].
Состав:
• пептон ферментативный,
• экстракт мясной,
• натрия хлорид, агар.
Мною использовался готовый мясо-пептонный агар.
Приготовление мясо-пептонного агара [2]:
• Перед использованием с бутылки с мясо-пептонным агаром я сняла алюминиевый колпачок, заменила резиновую пробку на ватно-марлевую. Выдержала бутылку с мясо-пептонным агаром в кипящей водяной бане до полного Расплавления студня, охладила до температуры 45-50 °С и разлила в стерильные чашки Петри слоем 4-5 мм. После застывания мясо-пептонный агар подсушила в течение 60 мин. В таком виде мясо-пептонный агар можно хранить в течение 10 суток в холодильнике.
Среда обеспечивает питательные потребности для роста культур в виде колоний на поверхности плотной питательной среды [2].
Выбор культуры
Для наблюдения взята культура Кишечная Палочка (E.Coli).
На МПА образует колонии в S-форме: слабовыпуклые полупрозрачные колонии с ровными краями и гладкой, блестящей поверхностью среднего размера.
Подтверждение проведено на среде Кода – питательная среда, предназначенная для выделения энтеробактерий и их идентификации по признаку ферментации лактозы.
Приготовление среды Кода [2]
В работе я использовала готовый порошок серовато-желтого цвета, который готовила следующим образом.
Согласно инструкции я взвесила 32,0 г питательной среды и размешала в 1 л дистиллированной воды. Кипятила 2 минуты и разлила по 5 мл в стерильные пробирки. Эта среда не требует автоклавирования. Я получила готовую среду прозрачно зеленого цвета [2].
|
Микроорганизм |
Наблюдаемый эффект |
|
Кишечная палочка (Escherichia coli) |
Помутнение и изменение цвета среды из зеленого в желтый цвет |
Наблюдаемый эффект получен через 1 сутки в теплом, темном месте.
Проведение основного наблюдения
Изучаемые факторы: температура, солнечный свет, повышенная влажность, СО2-атмосфера.
Контроль температуры проводился с помощью термометра. Отсутствие солнечного света создавалось с помощью алюминиевой фольги. Повышенная влажность создавалась с помощью флакона, наполненного водой. СО2-атмосфера была получена способом горения бытовых спичек под герметичной чашей. Характеристика изучаемых факторов представлена в Приложении 1.
В соответствии с изучаемыми факторами я разделила все объекты на 4 группы: три группы с разной температурой воздействия и одна контрольная группа. Характеристика групп представлена в Приложении 2.
Общее количество наблюдаемых объектов – 14.
Время роста культуры – 5 суток.
Описываемое наблюдение – наибольший размер колонии в мм.
По результатам наблюдений мною будут систематизированы полученные данные, сделаны выводы и заключения.
Обзор литературы
Кишечная палочка (эшерихия коли, лат. escherichiacoli; общепринятое сокращение E.Coli, по имени Теодора Эшериха) – вид грамотрицательных палочковидных бактерий, входящий в состав нормальной микрофлоры желудочно-кишечного тракта человека.
Вид эшерихия коли (e. coli) входит в род эшерихии (лат. escherichia), семейство энтеробактерии (лат. enterobacteriaceae), порядок энтеробактерии (лат. enterobacteriales), класс гамма-протеобактерии (лат. - proteobacteria), тип протеобактерии (лат. proteobacteria), царство бактерии.
Существует большое число разновидностей кишечной палочки (escherichiacoli), в том числе, более 100 патогенных, способных вызвать тяжелые заболевания [4].
Кишечные палочки. Общие сведения
Кишечные палочки (escherichia coli) устойчивы во внешней среде, длительное время сохраняются в почве, воде, фекалиях. Хорошо переносят высушивание. Кишечные палочки обладают способностью к размножению в пищевых продуктах, особенно в молоке.
Быстро погибают при кипячении и воздействии дезинфицирующих средств (хлорной извести, формалина, фенола, сулемы, едкого натра и др.).
Кишечные палочки более устойчивы во внешней среде по сравнению с другими энтеробактериями.
Прямой солнечный свет убивает их в течение нескольких минут, температура 60°С и 1% раствор карболовой кислоты – в течение 15 минут.
Часть кишечных палочек имеет жгутики и подвижны. У других кишечных палочек жгутики и способность к движению отсутствуют.
Escherichia coli в кишечнике человека появляются в первые дни после рождения и сохраняются на протяжении жизни.
Число кишечных палочек escherichia coli среди других представителей микрофлоры кишечника не превышает 1%, но они играют важнейшую роль в функционировании желудочно-кишечного тракта. Кишечные палочки e coli вырабатывают ряд необходимых для человека витаминов: В1, В2, В3, В5, В6, В9, B12, К, участвует в обмене веществ, оказывает влияние на всасывание железа и кальция [5].
Результаты работы
В ходе работы я вырастила колонии микроорганизма (кишечной палочки) и измерила максимальный диаметр колоний, полученных под влиянием заданных факторов внешней среды.
Все объекты были разделены на 4 группы.
• В группе 1 объекты наблюдались при температуре +18 +2 0С. При данной температуре получены следующие результаты: независимо от влажности при солнечном свете колонии не росли, при отсутствии солнечного света размер колоний был 1 мм. Под воздействием углекислого газа размер колоний остался 1 мм без повышенной влажности и достиг 2 мм в условиях повышенной влажности.
• В группе 2 объекты наблюдались при температуре +37 +2 0С. При данной температуре получены следующие результаты: при солнечном свете колонии в зависимости от отсутствия/наличия влажности не были обнаружены, без солнечного света – 6/8 мм, максимальный размер колоний получен при воздействии углекислого газа – это 7/9-10мм.
• В группе 3 объект наблюдался при температуре -20+2 0С. При данной температуре роста культуры не было.
• В группе 4 объект наблюдался при температуре +18 +200 С без культуры. В данном образце среда осталась чистой, посторонние культуры не образовались.
Полученные данные были мною систематизированы.
Максимальный диаметр колоний микроорганизмов, полученных под влиянием заданных факторов внешней среды, представлен в Приложении 3.
Выводы
В ходе мною было изучено влияние внешних факторов на рост выделенной культуры микроорганизмов в домашних условиях и сделаны следующие выводы:
Температура +37 +200С – наилучшая температура для роста колоний микроорганизмов.
Независимо от влажности и температуры, при действии прямого солнечного света рост колоний не обнаружен.
Температура -20 +20С не позволяет вырастить колонии микроорганизмов.
Повышенная влажность и СО2-атмосфера способствует росту микроорганизмов.
Сочетание благоприятных факторов, таких как температура +37 +2 0С, повышенная влажность и СО2-атмосфера позволяют вырастить наиболее крупные колонии микроорганизмов.
Приложение 1
Характеристика изучаемых факторов
|
Изучаемые факторы |
Характеристика изучаемых факторов |
|
Температура |
+18 +2 0С +37 +2 0С -20 +2 0С |
|
Солнечный свет |
наличие отсутствие |
|
Повышенная влажность |
наличие отсутствие |
|
СО2 – атмосфера |
наличие отсутствие |
Приложение 2
Группы изучаемых факторов и количество чашек Петри на подгруппу
Группа 1
|
Температура +18 +20С |
Наличие солнечного света |
Отсутствие солнечного света |
Отсут.солнечного света + СО2 |
|
Отсутствие повышенной влажности |
1-01*3 |
1-02*3 |
|
|
Наличие повышенной влажности |
1-03*3 |
1-04*3 |
Группа 2
|
Температура +37 +20С |
Наличие солнечного света |
Отсутствие солнечного света |
Отсут.солнечного света + СО2 |
|
Отсутствие повышенной влажности |
2-01*3 |
2-02*3 |
|
|
Наличие повышенной влажности |
2-03*3 |
2-04*3 |
Группа 3
|
Температура -20+20С |
Отсутствие солнечного света |
Наличие солнечного света |
|
Отсутствие повышенной влажности |
3-01*3 |
|
|
Наличие повышенной влажности |
Группа 4
|
Температура +18 +20С |
Отсутствие солнечного света |
Наличие солнечного света |
|
Отсутствие повышенной влажности |
4-01*3 |
|
|
Наличие повышенной влажности |
Приложение 3
Максимальный диаметр колоний микроорганизмов (мм), полученных под влиянием заданных факторов внешней среды.
Группа 1
|
Температура +18 +20С |
Наличие солнечного света |
Отсутствие солнечного света |
Отсут.солнечного света + СО2 |
|
Отсутствие повышенной влажности |
нет роста |
1 мм |
1 мм |
|
Наличие повышенной влажности |
нет роста |
1 мм |
1-2 мм |
Группа 2
|
Температура +37 +2 0С |
Наличие солнечного света |
Отсутствие солнечного света |
Отсут.солнечного света + СО2 |
|
Отсутствие повышенной влажности |
1 мм |
6 мм |
7 мм |
|
Наличие повышенной влажности |
1-2 мм |
8 мм |
9-10 мм |
Группа 3
|
Температура -20+2 0С |
Отсутствие солнечного света |
Наличие солнечного света |
|
Отсутствие повышенной влажности |
нет роста |
- |
|
Наличие повышенной влажности |
- |
- |
Группа 4
|
Контрольная чашка Без культуры Температура+18 +2 0С |
Отсутствие солнечного света |
Наличие солнечного света |
|
Отсутствие повышенной влажности |
нет роста |
- |
Приложение 4
Фотодокументирование работы

Подготовка питательной среды «мясо-пептонный агар»

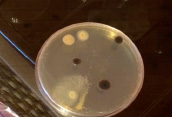
Получение первичной культуры

Первичный посев и определение кишечной палочки на среде Кода.

Подготовка к пересеву в чашки Петри выбранной культуры

Изучение полученной культуры микроорганизма
Заключение
В ходе работы мною были получены и изучены данные, позволяющие выделить наиболее благоприятные факторы для роста культуры микроорганизмов в домашних условиях.
Эти данные будут полезны для дальнейших работ по изучению свойств микробов и принести практическую пользу для здоровья людей, животных и нашей планеты.
Библиографическая ссылка
Панфёрова Д.Е. ИЗУЧЕНИЕ ВЛИЯНИЯ ВНЕШНИХ ФАКТОРОВ НА РОСТ МИКРООРГАНИЗМОВ В ДОМАШНИХ УСЛОВИЯХ // Старт в науке. 2018. № 5-2. ;URL: https://science-start.ru/ru/article/view?id=1081 (дата обращения: 04.03.2026).
