Синтез энантиомерно чистых соединений
Все мы когда-то болели и лечились лекарствами. Как все мы знаем главное в лекарствах не оболочка, а действующее вещество. Многие знают, такой лекарственный преппарат как ибупрофен. Он выступает в роли противоспалительного и жаропонижающего. Так из чего же он состоит и как его получают. А также как с этим связаны энантиомеры, рассмотрим в моем мини-исследовании.
Актуальность исследования
Актуальность работы. Интерес к производным имидазопиридина и пиридохиноксалина обусловлен широким спектром их биологической активности. Имидазо[4,5]пиридины являются анальгезирующими и нестероидными противовоспалительными агентами, проявляют антидепрессантное, кардиотоническое, гипотензивное, антиаритмическое и противосекреторное действие, среди соединений этого класса известны антагонисты ангиотензиновых II рецепторов. Кроме того, целый ряд имидазо[4,5-6]пиридинов проявляет противовирусную, антимикробную и цитотоксическую активность. Известны и другие аспекты практического применения производных имидазо[4,5]пиридинов, например, некоторые из них представляют собой селективные регуляторы роста растений и используются в качестве гербицидов.
Хорошо известна биологическая активность бензконденсированных производных пиразина. Производные 1,2,3,4-тетрагидро-2,3-диоксохиноксалина на основании своего сродства к NDMA- и АМРА-рецепторам широко используются в качестве лекарственных средств для лечения болезни Паркинсона, Альцгеймера, хореи Хантингтона и др. Особое внимание в последнее время уделяют производным 1,4-дигидро-'Пири-дино[2,3]пиразина, поскольку они, в отличие от производных хиноюсалина, существенно усиливают биологическое действие за счет высокого сродства к бензодиазепиновым рецепторам. Такие соединения можно применять для профилактики и лечения мышечных спазмов, инсультов, гипоксии, анок-чжи и эпилепсии.
Асимметрический синтез хиральных, эиантиомерно чистых органических соединений с заданной абсолютной конфигурацией атомов углеродного скелета привлекает все большее внимание и является динамично развивающейся областью органической химии. Интерес к синтезу энантиомерно чистых органических соединений связан с их практической ценностью, в основном, как компонентов биологически активных соединений, медицинских субстанций. Энантиомеры биологически активных соединений, как правило, обладают различной физиологической активностью и оказывают разное воздействие на организм. Различие может состоять не только в биологических воздействиях (эффектах), но, также, в фармакокинетике и метаболизме энантиомеров. Наконец, оптический антипод хирального лекарственного препарата может быть не только балластом, но и оказывать токсическое воздействие. Отражением данной тенденции стало появление в современной научной литературе термина «chiral switch», что в русском переводе означает «переключение на хирапьные молекулы».
Цель работы – Работа посвящена описанию методов синтеза ибупрофена.
Номенклатура энантиомеров
По оптической активности (+/–)
Энантиомер именуется по направлению, в котором его раствор вращает плоскость поляризации света. Если вращение происходит по часовой стрелке, то такой энантиомер называется (+), или правовращающим. Его оптический антипод именуется (–), или левовращающим. Данная номенклатура появилась до того, как были открыты методы установленияабсолютной конфигурацииэнантиомеров. Она является эмпирической и напрямую не связана с расположением атомов в пространстве.
По абсолютной конфигурации (R/S)
Проекция Фишераиабсолютнaя конфигурация.
R/S-Номенклатура является наиболее широко используемой в данное время, поскольку позволяет охарактеризовать энантиомер по егоабсолютной конфигурации. Это стало возможным благодаря открытиюрентгеноструктурного анализа, позволяющего установить точное пространственное расположение атомов в молекуле.
Данный вид номенклатуры основывается на присвоении хиральному атому углерода обозначенияRилиSна основании взаимного расположения четырёх связанных с ним заместителей. При этом для каждого из заместителей определяют старшинство в соответствии справилами Кана— Ингольда— Прелога, затем молекулу ориентируют так, чтобы младший заместитель был направлен в сторону от наблюдателя, и устанавливают направление падения старшинства остальных трёх заместителей. Если старшинство уменьшается по часовой стрелке, то конфигурацию атома углерода обозначаютR(англ.right— правый). В противоположном случае конфигурацию обозначаютS(лат.sinister— левый)[2][3].
Если соединение содержит лишь один хиральный центр, то его конфигурация указывается в названии в виде приставки. Если в соединении находится несколько стереоцентров, нужно обозначить конфигурацию каждого.
R/S-Номенклатура не имеет непосредственной связи с (+/–)-обозначениями. Например,R-изомер может быть как правовращающим, так и левовращающим, в зависимости от конкретных заместителей при хиральном атоме.
По относительной конфигурации (D/L)
D/L-Номенклатура была введенаЭ. Фишеромдля описания относительной конфигурации моносахаридов. Она основана на конфигурацииглицеринового альдегида, существующего в виде двух энантиомеров, из которых путём последовательных реакций наращивания углеродной цепи можно получить производные моносахариды (тетрозы, пентозы, гексозы ит.д.). Поскольку в ходе наращивания углеродной цепи стереоцентр глицеринового альдегида не затрагивается, все производные сахара, по Фишеру, получают то же обозначение относительной конфигурации, что и исходный глицериновый альдегид. Обозначения для энантиомеров глицеринового альдегида были присвоены Фишером произвольно.
В настоящее время современные методы установления структуры соединений позволяют характеризовать конфигурацию моносахаридов, не сравнивая их с глицериновым альдегидом.
Определение энантиомеров и их виды
Энантиомеры— парастереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве. Классической иллюстрацией двух энантиомеров могут служить правая и левая ладони: они имеют одинаковое строение, но различную пространственную ориентацию. Существование энантиомерных форм связано с наличием у молекулыхиральности— свойства не совпадать в пространстве со своим зеркальным отражением. В ахиральной (симметричной) среде энантиомеры имеют одинаковые химические и физические свойства, кроме способностивращать плоскость поляризацииплоскополяризованногосвета на одинаковую величину угла, но в противоположных направлениях. Данное свойство энантиомеров получило названиеоптической активности(оптической изомерии, а сами вещества — оптических изомеров).
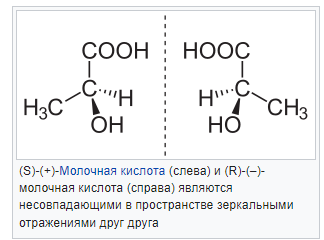
Большинство хиральных природных соединений (аминокислоты,моносахариды) существует в виде одного энантиомера. Понятие энантиомерии играет важную роль вфармацевтике, поскольку разные энантиомерылекарственных веществ, как правило, имеют различнуюбиологическую активность [1].
Примеры
Молекула противовоспалительного препаратаибупрофенаимеет один стереоцентр в α-положении ккарбоксильной группе, поэтому она существует в виде двух энантиомеров. Ибупрофен, производимый в промышленности, являетсярацемической смесью. Установлено, что биологической активностью обладает лишь один энантиомер— (S)-(+)-ибупрофен. В то время как его оптический антипод (R)-(–)-ибупрофен в организме неактивен. В связи с этим стало коммерчески доступно аналогичное лекарственное средство, представляющее собой энантиомерно чистый (S)-(+)-ибупрофен, т.н. дексибупрофен. В ходе дальнейших исследований было обнаружено, что в организме человека присутствуетизомераза, способная превращать неактивный (R)-(–)-ибупрофен в активный (S)-(+)-ибупрофен.
Другим примером могут служить антидепрессантыциталопрамиэсциталопрам. Циталопрам является рацемической смесью (R)-циталопрама и (S)-циталопрама. Эсциталопрам является индивидуальным (S)-энантиомером. Было показано, что эсциталопрам более эффективен при лечениидепрессивных состояний, чем аналогичная доза циталопрама.
Синтез ибупрофена
Ибупрофен (нурофен) – (RS)-2-(4-изобутилфенил)-пропионовая кислота (синонимы: нурофен, бруфен, бурана и др.) может быть получен двумя способами. Первый способ, представленный на схеме 1, заключается в ацилировании изобутилбензола хлорангидридом уксусной кислоты в присутствии хлорида аммония в качестве катализатора с последующим цианированием полученного продукта и восстановлении цианогруппы до карбоксигруппы [4].
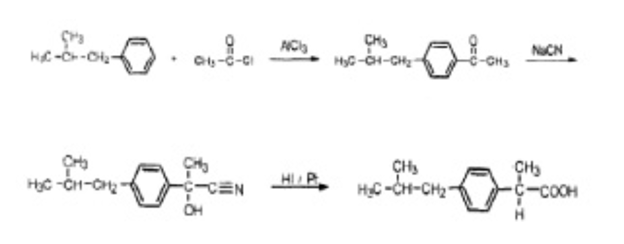
Схема 1. Синтез ибупрофена ацилированием изобутилбензола
Второй способ синтеза ибупрофена (по схеме 2) заключается в хлорметилировании изобутилбензола формальдегидом и хлористым водородом в присутствии цинка хлорида с получением 4-изобутилбензилхлорида, его цианировании, и восстановлении цианогруппы до карбоксигруппы [2].
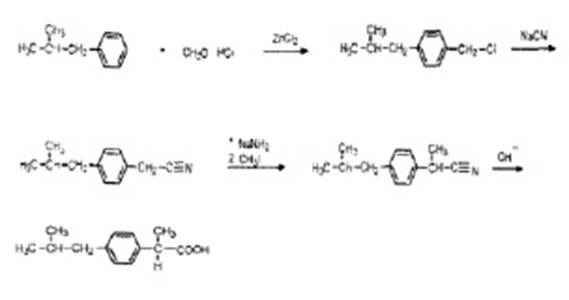
Схема 2. Синтез ибупрофена хлорметилированием изобутилбензола
Выводы
Итак, Энантиомеры— парастереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве. Классической иллюстрацией двух энантиомеров могут служить правая и левая ладони: они имеют одинаковое строение, но различную пространственную ориентацию. В их число входят многие лекарства, в том числе очень эффективный ибупрофен.
