Введение.
Молоко является ценным пищевым продуктом, так как содержит много ценного по составу и легкоусвояемого белка, важного для нашего организма. Эти сложные молекулы, состоящие из более простых аминокислот, оказались универсальны, из-за чего заняли очень важную роль в жизни организмов: белки являются составляющими клеток, их незаменимой частью, давая им различные и специфичные свойства, дополнительно контролируя всё живое. Такие свойства белок приобретает из-за наличия структур – вторичной, третичной, четвертичной. Данные структуры белковой молекулы непрочные и могут быть легко разрушены воздействием извне. Такое разрушение структуры называется денатурацией.
Денатурация не нарушает порядок аминокислот, но меняет глобальную структуру белка, нарушая стандартную работу белка, изменяя изначальные свойства. Так, белки перестают растворяться, теряют гидрофильность, слипаются в комки. Причин денатурации достаточно много: от изменения температуры, до чрезмерного излучения и концентрации некоторых веществ, например, кислот, солей тяжёлых металлов. Тема денатурации и ее скорости меня очень заинтересовала и я решил сделать учебный проект.
Целями моего проекта можно назвать изучение процесса денатурации белков молока и предположение механизмов воздействия вещества, которое является причиной денатурации белков в каждом отдельном случае.
Для достижения этих целей, я поставил следующие задачи:
· найти в литературе и изучить информацию об особенности белков молока;
· изучить процесс денатурации и его визуальные проявления;
· изучить вещества, вызывающие денатурацию белков, и влияние их концентрации на скорость денатурации (в некоторых случаях);
· предположить механизм воздействия вещества, которое является причиной денатурации белков в каждом отдельном случае;
· проанализировать полученные результаты, сделать выводы.
В качестве объектов исследования я взял пищевое молоко и вещества, способные к денатурации (соли тяжёлых металлов, спирты, кислоты, щелочи), а в качестве предмета исследования – скорость и глубину денатурации белков в зависимости от концентрации и особенностей вещества.
Краткий обзор теоретических сведений о строении и свойствах белков молока.
Белки представляют основу структурных элементов клеток и тканей, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 аминокислот. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его функционирования в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс.
В молоке содержится в среднем 3,5% белков. Наибольшая доля принадлежит казеину (2-4%), содержание молочного альбумина 0,5-1%, молочного глобулина 0,1%, присутствуют также белки оболочек жировых шариков (до 0,01 %).
Как правило, белки достаточно стабильны в тех условиях, в которых они в норме функционируют в организме. Резкое изменение этих условий приводит к денатурации белка.
Денатурацией белка называют любые изменения в его биологической активности и/или физико-химических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры. (рис. 1).
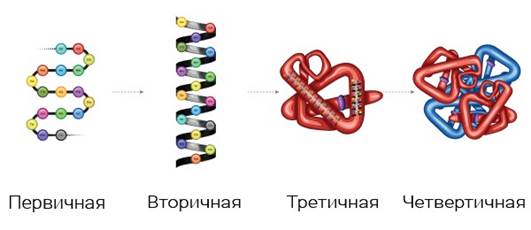
Рис. 1. Структуры белка
Под первичной структурой понимают последовательность аминокислотных остатков в полипептидной цепи. Вторичная структура – упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Третичная структура – укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами.
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникнуть при воздействии температуры, химических веществ, при нагревании и облучении. Таким образом, денатурация белка может быть вызвана различными относительно мягкими воздействиями, приводящими к нарушению в его молекулах слабых взаимодействий — водородных, ионных связей и гидрофобных контактов, а также к разрыву дисульфидных связей, стабилизирующих нативную структуру белка. При этом нарушаются вторичная, третичная и четвертичная структуры белковых молекул, но не нарушаются ковалентные связи в полипептидной цепи, следовательно, не нарушается первичная структура белка.
В зависимости от природы денатурирующего агента, выделяют:
· механическую (сильное перемешивание или встряхивание),
· физическую (нагревание, охлаждение, облучение, обработка ультразвуком)
· химическую (кислоты и щёлочи, поверхностно-активные вещества, мочевина) денатурацию.
К нарушению различных связей в большинстве белков приводит прежде всего их нагревание до температуры выше 50°С, а также ультрафиолетовое и другие виды высокоэнергетического облучения, что обусловлено усилением колебаний атомов полипептидной цепи. Денатурацию белка способны вызвать даже механические воздействия, например сильное взбалтывание раствора белка.
Денатурация белков также может происходить вследствие какого- либо химического воздействия, например в присутствии некоторых органических растворителей (спирта, ацетона и др.), мочевины, ионов тяжелых металлов и др., а также в условиях экстремальных значений pH среды.
Визуально денатурация выглядит, например, как образование хлопьев, осадка или побеление жидкого и почти прозрачного яичного белка при жарке яиц. В молоке это проявляется уплотнением раствора и образованием комков от свёртывания белков, в том числе хорошо видимых на стенках стеклянной посуды и посредством стеклянной палочки. Этим свойством мы и будем пользоваться для определения влияния различных веществ на степень денатурации белка.
Краткий обзор факторов, влияющих на скорость денатурации
Основными факторами денатурации белков являются:
1. Изменение pH
2. Специфичное воздействие спиртов;
3. Специфичное воздействие ионов тяжёлых металлов;
4. Изменение температуры (рассматриваться не будет)
5. Излучение и ионизация (рассматриваться не будет), и некоторые другие.
Данные факторы делятся на группы механического, физического и химического воздействия, а так как мой проект по химии, то я буду изучать только химическое воздействие.
Основным химическим фактором, значимым для денатурации белковых молекул, является изменение pH (кислотности). Это значит, что в воде, которая окружает белковые молекулы, возрастает (среда становится сильно кислой) или падает (среда становится сильно щелочной) концентрация ионов H+. Такие изменения в концентрации ионов закономерно изменяют заряд белковых молекул, возникает ионизация кислотных и основных групп. Из-за этого меняется их конфигурация в пространстве, рвутся водородные связи и утрачивается третичная и даже вторичная структуры. Данные изменения происходят достаточно быстро. Кислоты также достаточно активные вещества (окислители), поэтому могут также непосредственно разрывать связи между атомами в достаточно большой молекуле белка.
Щёлочи же в свою очередь легче (менее заметно) влияют на заряды белковых молекул, из-за чего белки практически денатурируют медленнее, они сворачиваются значительно мягче, чем при добавлении кислот.
Органические растворители — спирты, фенолы и другие — также нарушают в белках систему водородных связей в результате конкуренции с функциональными группами белков за их образование. Кроме этого, органические растворители вследствие установления контактов с неполярными радикалами остатков аминокислот нарушают в белках гидрофобные взаимодействия. Высокие концентрации мочевины или органических растворителей вызывают нарушение структуры воды, что также приводит к ослаблению в белковых молекулах гидрофобных взаимодействий. Таким образом, спирт и мочевина осаждает белки из раствора практически сразу же. Белок уплотняется, становятся заметны изменения физических и химических свойств.
Органические вещества, которые не растворяются в воде (гидрофобные молекулы), как правило, не имеют полярности в молекуле (или заряда) и не оказывают влияния на молекулы белка.
Ионы тяжелых металлов в свою очередь тоже имеют заряд и могут присоединяться к белкам, образуя альбуминаты. Однако, из-за большего радиуса чем у лёгких металлов, они меняют электрическое поле белка, заставляя тех образовать так называемые «кластеры» (слипание комков белка). Из-за этого молекулы больше не могут отталкиваться друг от друга, а наоборот притягиваются, что и позволяет им объединяться в довольно большие соединения (сгустки), нарушается растворимость белковых молекул. Степень и скорость денатурации определяется концентрацией ионов тяжелых металлов и степенью диссоциации их солей: малая концентрация солей тяжелых металлов вызывает гелификацию (уплотнение) белков на поверхности, большая концентрация вызывает необратимые глубокие изменения белковых молекул.
Также, некоторые тяжёлые металлы образуют прочную связь с тиольными группами, что также нарушает работу белковых молекул, делает молекулы более тяжелыми, нерастворимыми.
План проведения эксперимента.
Все исследования в рамках данного проекта осуществлялись в школьной лаборатории с соблюдением правил техники безопасности при работе с едкими веществами (кислотами, щелочами), с веществами, являющимися ядами. Опыты с летучими (сильно пахнущими) веществами, а также с концентрированными кислотами проводились с использованием вытяжного шкафа.
План проведения исследования:
1. Для исследования брали по 30 мл молока, 3,2% жирности. Молоко наливали в различные химические стаканы. Подписывали (нумеровали) емкости.
2. В каждую порцию молока наливали по 20 мл растворов различных химических веществ, в том числе:
2.1 10% растворы солей тяжёлых металлов (FeCl3, CuCl2, Pb(CH3COO)2, CdSO4, ZnSO4, BaCl2) и для сравнения 10% растворы солей более легких металлов (Na2CO3, NaCl, Na2S, Na2SO4, CaCl2, NH4Cl, MnSO4, CoSO4, NiSO4, CrCl2)
2.2 98%-100% растворы спиртов (этанол, бутанол) и других органических веществ (гептан, гексан, толуол, глицерин, гликоль).
2.3 концентрированные кислоты 98% растворы серной и азотной кислот, 70% раствор уксусной кислоты, разбавленные кислоты 25%, 10%, 1% растворы кислот (уксусная, серная и азотная кислоты)
2.4. 10% растворы щелочей (KOH, NaOH).
3. Оценивали: степень денатурации сразу после добавления веществ, через 2 часа и через сутки после смешивания. Оценку проводили по характеру сгустка (размешивание стеклянной палочкой), характеру комков и следов на стенках химического стакана, изменению цвета (в некоторых образцах), наличию отделяемой воды (выпадение осадка).
4. Фотографировали полученный результат.
5. Описывали результаты в таблице, формулировали выводы.
Описание результатов по исследованию молока.
Действие на молоко различных кислот, в том числе серной, уксусной, азотной. Результаты представлены в таблице 1. Действие на молоко различных спиртов и иных органических соединений. Результаты представлены в таблице 2. Действие на молоко различных солей. Результаты представлены в таблице 3. Действие на молоко растворов щелочей: гидроксида натрия NaOH, гидроксида калия KOH и гидроксида кальция Ca(OH)2. Результаты представлены в таблице 4.
Таблица 1. Действие на молоко различных кислот.
|
Вещество |
Концентрация |
Время |
Результат |
|
Уксусная кислота |
70% |
Сразу |
Сворачивание белка, уплотнение раствора, плотный сгусток, стеклянная палочка размешивает с трудом. |
|
Уксусная кислота |
10% |
3-4 мин |
Сворачивание белка, уплотнение раствора, мелкие хлопья на стенке. |
|
Серная кислота |
98% |
Сразу |
Изменение цвета на темно коричневый (реакция с органическими веществами), эффект обугливания. Сворачивание белка, уплотнение раствора, очень плотный сгусток, реакция почти мгновенная. |
|
Серная кислота |
50% |
Сразу |
Сворачивание белка, уплотнение раствора, плотный сгусток, стеклянная палочка размешивает с трудом. На следующие сутки потемнение раствора. |
|
Серная кислота |
25% |
Сразу |
Сворачивание белка, уплотнение раствора, достаточно плотный сгусток. |
|
Серная кислота |
10% |
Сразу |
Сворачивание белка, уплотнение раствора, достаточно плотный сгусток. |
|
Серная кислота |
1% |
2-3 мин |
Сворачивание белка, уплотнение раствора, мелкие хлопья на стенках |
|
Азотная кислота |
98% |
Сразу |
Изменение цвета на желтый (специфическая реакция на белки). Сворачивание белка, уплотнение раствора, очень плотный сгусток, реакция почти мгновенная. |
|
Азотная кислота |
50% |
Сразу |
Сворачивание белка, уплотнение раствора, плотный сгусток, стеклянная палочка размешивает с трудом. Цвет желтоватый, со временем более темный. |
|
Азотная кислота |
10% |
Сразу |
Сворачивание белка, уплотнение раствора, достаточно плотный сгусток. |
|
1. Через 2 часа наблюдения – результаты наблюдения те же. 2. Через сутки – изменения имеются, в частности в пробах с большой концентрацией приливаемой кислоты отделилась вода (сверху), сгусток белка уплотнился и всплыл, на дне стакана отделяемая жидкость. 3. Цвет в пробах с концентрированными кислотами серной и азотной стал более насыщенным, темным. |
|||
Таблица 2. Действие на молоко различных спиртов и органических соединений.
|
Вещество |
Время |
Результат |
|
Гептан |
Сразу/ через 2 часа/ через сутки. |
Ничего не произошло. |
|
Гексан |
Сразу/ через 2 часа/ через сутки. |
Ничего не произошло. |
|
Этанол |
В течение 4-5 минут. |
Сворачивание белка, уплотнение раствора, достаточно плотный сгусток. Через сутки оседание сгустка, сверху слой воды. |
|
Пропанол |
Сразу. |
Сворачивание белка, уплотнение раствора, достаточно плотный сгусток. |
|
Толуол |
Сразу/ через 2 часа/ через сутки. |
Ничего не произошло. |
|
Глицерин |
Сразу/ через 2 часа/ через сутки. |
Ничего не произошло. |
|
Гликоль |
Сразу/ через 2 часа/ через сутки. |
Сразу изменений нет, через сутки сворачивание белка, мелкие хлопья. |
|
.Во всех случаях использовалось чистое вещество, без разбавления. Через 2 часа наблюдения, через сутки – результаты наблюдения те же. Расслоение почти незаметно, вода отделилась неактивно. |
||
Таблица 3.Действие на молоко различных солей.
|
Вещество |
Время |
Результат |
|
Карбонат натрия Na2CO3 |
Сразу/ через 2 часа/ через сутки. |
Ничего не произошло. |
|
Хлорид натрия NaCl |
То же |
Ничего не произошло. |
|
Сульфид натрия Na2S |
То же |
Ничего не произошло. |
|
Сульфат натрия Na2SO4 |
То же |
Ничего не произошло. |
|
Хлорид кальция CaCl2 |
То же |
Ничего не произошло. |
|
Хлорид железа (III) FeCl3 |
В течение 10-15 минут |
Сворачивание белка, мелкие хлопья, сгусток рыхлый. Изменение цвета молока за счет окрашенной соли. |
|
Хлорид меди CuCl2 |
Сразу |
Сворачивание белка, хлопья средней величины, сгусток достаточно плотный. Изменение цвета молока за счет окрашенной соли. Заметное увеличение плотности через сутки. |
Таблица 3 (продолжение). Действие на молоко различных солей.
|
Вещество |
Время |
Результат |
|
Хлорид аммония NH4Cl |
Сразу/ через 2 часа/ через сутки. |
Ничего не произошло. |
|
Сульфат марганца MnSO4 |
То же |
Изменение цвета молока за счет окрашенной соли. Сворачивание через продолжительное время. |
|
Сульфат кобальта CoSO4 |
То же |
Изменение цвета молока за счет окрашенной соли. Сворачивание через продолжительное время. |
|
Сульфат никеля NiSO4 |
То же |
Изменение цвета молока за счет окрашенной соли. Сворачивание через продолжительное время. |
|
Хлорид бария BaCl2 |
То же |
Ничего не произошло. |
|
Сульфат кадмия CdSO4 |
Сразу |
Очень быстрое сворачивание белка до крупных комков, большая плотность. |
|
Сульфат цинка ZnSO4 |
Сразу |
Очень быстрое сворачивание белка до крупных комков, большая плотность. Через сутки наиболее характерное расслаивание. |
|
Ацетат свинца + Уксусная кислота Pb(CH3COO)2 |
Сразу |
Очень быстрое сворачивание белка до крупных комков, большая плотность, стеклянная палочка поворачивается с трудом. Крупные хлопья на стенках. |
|
Ацетат Свинца без кислоты Pb(CH3COO)2 |
Сразу |
Незначительная реакция, слабее чем с уксусной кислотой. |
|
Хлорид Хрома CrCl2 |
Почти сразу. |
Сворачивание белка, мелкие хлопья, сгусток рыхлый. Изменение цвета молока за счет окрашенной соли. |
|
1. Во всех случаях использовался 10% раствор солей. 2. Соли тяжелых металлов давали яркую, почти мгновенную реакцию. 3. Окрашенные соли изменяли цвет молока, что иногда затрудняло оценку результата. 4. Через 2 часа наблюдения, через сутки – результаты наблюдения те же, если реакции не было. При наличии реакции – молоко расслаивалось, но не слишком много, образовывался слой воды высотой 2-6 мм |
||
Таблица 4.Действие на молоко щелочей.
|
Вещество |
Время |
Результат |
|
Гидроксид калия KOH |
Сразу/ через 2 часа/ через сутки. |
Сразу ничего не произошло. Изменения были заметны через продолжительное время. Через сутки очень сильная денатурация, значительное расслоение, изменение цвета. |
|
Гидроксид натрия NaOH |
То же |
Сразу ничего не произошло. Изменения были заметны через продолжительное время. Через сутки очень сильная денатурация, значительное расслоение, изменение цвета. |
|
Гидроксид кальция Ca(OH)2 |
То же |
Ничего не произошло. Через сутки слабая денатурация. |
|
1. .Во всех случаях использовался 10% раствор щелочи. 2. Через 2 часа наблюдения изменений нет, через сутки – в пробах с NaOH и KOH изменение цвета, сильная денатурация, расслоение. |
||
Выводы по результатам исследования молока.
По результатам экспериментов, я пришел к следующим выводам:
· Денатурация белков (в частности химическая) происходит достаточно быстро и имеет характерные признаки, которые легко идентифицировать;
· Вследствие непрочности химических связей (водородные и проч.), которые образуют вторичную, третичную и четвертичную структуры белка, многие вещества способны вызвать денатурацию белка, в основном это соли тяжёлых металлов, кислоты и некоторые органические вещества.
· По результатам экспериментов, было показано, что наибольшим воздействием на белки обладают кислоты, растворимые соли железа, меди, цинка, свинца, кадмия и хрома;
· Соли щелочных металлов и более легких металлов не проявляют эффекта денатурации или он незаметен;
· Щёлочи проявляют эффект денатурации медленно, но со временем изменения значительные;
· Органические соединения, нерастворимые в воде не вызывали денатурацию белков молока, при этом денатурация от прибавления одноатомных спиртов была значительная и достаточно быстрая;
· Скорость денатурации белка у каждого вещества разная: самые быстрые результаты показали кислоты, соли свинца, кадмия, цинка;
· Видимая степень денатурации белка тоже разнилась: самыми показательными оказались концентрированные кислоты, соли свинца, кадмия;
· Небольшие количества кислоты, солей свинца, кадмия и других металлов также приводили к денатурации, но не так выраженно;
· Скорость денатурации напрямую зависит от концентрации, особенно это характерно для кислот. Но выразить этот показатель количественно пока невозможно;
· Все способы фиксировать денатурацию оказались оценочными, разной степени достоверности, в зависимости от возможностей наблюдателя. Измерить степень и скорость денатурации пока не представляется возможным.
Заключение.
Денатурация белков имеет большое значение в явлениях живого мира. Так, по мере старения организмов происходит постепенная, хотя и очень медленная, денатурация белков, сопровождающаяся снижением их гидрофильности. Этот процесс имеет место и очень важен в целом ряде процессов пищевой промышленности — при выпечке хлеба и кондитерских изделий, сушке макарон, изготовлении консервов и т.д. Денатурированные (частично разрушенные) белки, как правило, значительно легче усваиваются организмом, так как в процессе пищеварения они легче гидролизуются под воздействием специфических катализаторов — ферментов. Следовательно, денатурация белков, происходящая в ходе производства пищевых продуктов, а также приготовления пищи, имеет положительное значение, так как в результате нее повышается степень усвоения белков.
Однако с развитием науки и технологий в наш быт проникали всё новые и новые вещества, в том числе и не совсем полезные. Так, в Древней Греции, в качестве материала для винных сосудов использовали свинец, медь же и другие металлы использовали как красители для тканей, а в восемнадцатом веке и позже как лекарство использовали жидкую ртуть и её алые соли, потребляя данное «лечебное зелье» без какого либо страха, не зная об опасности подобных металлов.
Год назад, я задался вопросом - "настолько ли опасны тяжёлые металлы и другие вещества, в том числе органические растворители для человека? Возможно ли навредить себе?", и с этими вопросами я начал экспериментировать и углубляться в вопрос, постепенно узнавая всё новые детали мира вокруг, и смог их проверить, лично подтвердив денатурацию белков от тяжёлых металлов и других веществ.
